ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS) [MELAS]
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS)の高次脳機能障害
要約
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群の脳卒中様病変は側頭,頭頂,後頭葉に生じることが多く,この病変分布と関連した高次脳機能障害がしばしばみられ,皮質盲をはじめ,各種の失認や失語症などが報告されている。一方,このような局所性脳病変によるもの以外に,全般性脳障害に起因するミトコンドリア認知症という病態も提唱されており,遂行機能障害をはじめとする高次脳機能障害が報告されている。
はじめに
ミトコンドリアはエネルギーを産生する細胞内小器官であり,骨格筋や中枢神経組織はミトコンドリアエネルギーに最も依存しているため,ミトコンドリア病では骨格筋や中枢神経の障害をきたしやすい。
ミトコンドリア病の代表的な病型としては,本稿で扱うミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(mitochondrial encephalo-myopathy,lactic acidosis and stroke-like episodes:MELAS)のほか, …(中略)…
この中でも最も多い病型は,頭痛,てんかん,および脳卒中様発作を臨床的特徴とするMELASである。
MELASにおける脳卒中様発作は一般の脳血管障害とは異なる特徴を有するが,大脳皮質を中心とした局所性脳病変が出現することにより,種々の高次脳機能障害を呈し得る。一方,脳卒中様発作とは異なる病態に基づく変性過程によるものとして,より全般性の脳障害に起因する高次脳機能障害についても報告されており,ミトコンドリア認知症という概念として捉える立場もある。ここでは,MELASの脳卒中様発作による局所性脳病変に起因する高次脳機能障害と,全般性脳障害に起因する高次脳機能障害とに分けて論じることにする。
Ⅰ. 脳卒中様発作による局所性脳病変に起因する高次脳機能障害
1. 脳卒中様発作の特徴
MELASに特徴的な神経症候は,片頭痛発作類似の悪心,嘔吐を伴う頭痛発作,繰り返すてんかん発作,および脳卒中様発作である。
…(中略)…
中核症状である脳卒中様発作の病態はいまだ不明な点も多いが,その出現頻度は84~99%とされる。MELASによる脳卒中様発作における脳病変の特徴は,血管支配領域とは一致しない大脳皮質を中心とする浮腫性病変であり,出現する局所性脳病変によりさまざまな高次脳機能障害が起こり得る。しかし,一般の脳血管障害とは異なり,MELASの脳卒中様発作における初期病変は,しばしば数週間かけて周辺皮質に連続的に進展するほか,てんかん発作を伴うことも多い。また,病巣の消退を伴う神経症候の改善をみることが多い点も一般の脳血管障害の臨床経過とは異なっている。さらには,しばしば脳卒中様発作を繰り返しながら,高次脳機能障害は段階的に増悪する。
…(中略)…
このような背景のためか,MELASの脳卒中様発作における高次脳機能障害に関する系統的な研究報告は見当たらない。一方,MELASの脳卒中様発作における病巣分布パターンとしては,側頭,頭頂,後頭葉に生じることが多いことが知られている。
…(中略)…
2.視覚性の高次脳機能障害
高次脳機能障害としてしばしばみられるのは,後頭葉の病変に起因する視覚に関連した症候であり,両側の後頭葉から視放線の病変による皮質盲の頻度が高いことが総説や症例集積研究において記されている。
3. 言語障害
4. その他の症候
…(中略)…
「視線を動かしても一度みた映像が持続してみえる」という視覚性保続や,「みえないはずの位置に実際の映像がみえる」といった視覚性知覚転位などの特異な症候が経過中の一時点において観察され,症候出現の背景としてはてんかん性の病態の関与も想定された。
…(中略)…
Ⅱ. 全般性脳障害に起因する高次脳機能障害(ミトコンドリア認知症)
MELASでは認知症と呼べる状態に陥る頻度は40~90%と高いとされているが,脳卒中様発作による局所性脳病変の蓄積が少なからず関与しているものと推測される。
(以下省略)
【市川博雄:ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS)の高次脳機能障害. BRAIN and NERVE vol.68 151-157 2016】
私の感想:
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS)って聞き慣れない病名です(少なくとも私は経験がありません)が、見方によっては、レビー小体型認知症とよく似た状態を起こしますよね。
ですから、レビー小体型認知症(DLB)の鑑別診断として念頭に置くべきかも知れません。ただし、DLBは高齢発症であるのに対して、MELASの報告例は比較的若年発症のケースが多いようですから、鑑別診断として考える必要はなさそうですね。
市川博雄先生の所属は、昭和大学藤が丘病院(横浜市)の脳神経内科となっております。
要約
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群の脳卒中様病変は側頭,頭頂,後頭葉に生じることが多く,この病変分布と関連した高次脳機能障害がしばしばみられ,皮質盲をはじめ,各種の失認や失語症などが報告されている。一方,このような局所性脳病変によるもの以外に,全般性脳障害に起因するミトコンドリア認知症という病態も提唱されており,遂行機能障害をはじめとする高次脳機能障害が報告されている。
はじめに
ミトコンドリアはエネルギーを産生する細胞内小器官であり,骨格筋や中枢神経組織はミトコンドリアエネルギーに最も依存しているため,ミトコンドリア病では骨格筋や中枢神経の障害をきたしやすい。
ミトコンドリア病の代表的な病型としては,本稿で扱うミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(mitochondrial encephalo-myopathy,lactic acidosis and stroke-like episodes:MELAS)のほか, …(中略)…
この中でも最も多い病型は,頭痛,てんかん,および脳卒中様発作を臨床的特徴とするMELASである。
MELASにおける脳卒中様発作は一般の脳血管障害とは異なる特徴を有するが,大脳皮質を中心とした局所性脳病変が出現することにより,種々の高次脳機能障害を呈し得る。一方,脳卒中様発作とは異なる病態に基づく変性過程によるものとして,より全般性の脳障害に起因する高次脳機能障害についても報告されており,ミトコンドリア認知症という概念として捉える立場もある。ここでは,MELASの脳卒中様発作による局所性脳病変に起因する高次脳機能障害と,全般性脳障害に起因する高次脳機能障害とに分けて論じることにする。
Ⅰ. 脳卒中様発作による局所性脳病変に起因する高次脳機能障害
1. 脳卒中様発作の特徴
MELASに特徴的な神経症候は,片頭痛発作類似の悪心,嘔吐を伴う頭痛発作,繰り返すてんかん発作,および脳卒中様発作である。
…(中略)…
中核症状である脳卒中様発作の病態はいまだ不明な点も多いが,その出現頻度は84~99%とされる。MELASによる脳卒中様発作における脳病変の特徴は,血管支配領域とは一致しない大脳皮質を中心とする浮腫性病変であり,出現する局所性脳病変によりさまざまな高次脳機能障害が起こり得る。しかし,一般の脳血管障害とは異なり,MELASの脳卒中様発作における初期病変は,しばしば数週間かけて周辺皮質に連続的に進展するほか,てんかん発作を伴うことも多い。また,病巣の消退を伴う神経症候の改善をみることが多い点も一般の脳血管障害の臨床経過とは異なっている。さらには,しばしば脳卒中様発作を繰り返しながら,高次脳機能障害は段階的に増悪する。
…(中略)…
このような背景のためか,MELASの脳卒中様発作における高次脳機能障害に関する系統的な研究報告は見当たらない。一方,MELASの脳卒中様発作における病巣分布パターンとしては,側頭,頭頂,後頭葉に生じることが多いことが知られている。
…(中略)…
2.視覚性の高次脳機能障害
高次脳機能障害としてしばしばみられるのは,後頭葉の病変に起因する視覚に関連した症候であり,両側の後頭葉から視放線の病変による皮質盲の頻度が高いことが総説や症例集積研究において記されている。
3. 言語障害
4. その他の症候
…(中略)…
「視線を動かしても一度みた映像が持続してみえる」という視覚性保続や,「みえないはずの位置に実際の映像がみえる」といった視覚性知覚転位などの特異な症候が経過中の一時点において観察され,症候出現の背景としてはてんかん性の病態の関与も想定された。
…(中略)…
Ⅱ. 全般性脳障害に起因する高次脳機能障害(ミトコンドリア認知症)
MELASでは認知症と呼べる状態に陥る頻度は40~90%と高いとされているが,脳卒中様発作による局所性脳病変の蓄積が少なからず関与しているものと推測される。
(以下省略)
【市川博雄:ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS)の高次脳機能障害. BRAIN and NERVE vol.68 151-157 2016】
私の感想:
ミトコンドリア脳筋症・乳酸アシドーシス・脳卒中様発作症候群(MELAS)って聞き慣れない病名です(少なくとも私は経験がありません)が、見方によっては、レビー小体型認知症とよく似た状態を起こしますよね。
ですから、レビー小体型認知症(DLB)の鑑別診断として念頭に置くべきかも知れません。ただし、DLBは高齢発症であるのに対して、MELASの報告例は比較的若年発症のケースが多いようですから、鑑別診断として考える必要はなさそうですね。
市川博雄先生の所属は、昭和大学藤が丘病院(横浜市)の脳神経内科となっております。
PINK1蛋白とミトコンドリア [パーキンソン病]
PINK1蛋白とミトコンドリア
PINK1遺伝子は2004年に3番目の常染色体劣性遺伝型パーキンソン病(PD)の原因遺伝子として同定された.PINK1蛋白はミトコンドリアに局在するリン酸化酵素と考えられ,おもに分子生物学・細胞生物学的手法によりPINK1蛋白に関する機能解析が行われてきた.本蛋白の機能低下によるミトコンドリアの呼吸機能障害,ミトコンドリアのカルシウム(Ca)ホメオスタシスの異常,ミトコンドリアを含む酸化ストレス上昇などが報告されている.近年では,PINK1とミトコンドリアダイナミクスとの関連や,ミトコンドリア内膜電位維持との関係が指摘されている.さらに,別の劣性遺伝型PD遺伝子産物Parkinと協調し,不要となったミトコンドリアのautophagyによる処理(mitophagy)に関与している可能性も報告されている.したがって,PINK1遺伝子はPDとミトコンドリアという観点から注目されている.本稿ではこの約10年間の研究の流れを概説し,主だった仮説を紹介する.
【北田 徹:PINK1蛋白とミトコンドリア. 医学のあゆみ vol.247 1031-1037 2013】
私の感想:
難しすぎてコメント不可です。
詳細は↓
https://www.ishiyaku.co.jp/magazines/ayumi/AyumiArticleDetail.aspx?BC=924710&AC=13365
PINK1遺伝子は2004年に3番目の常染色体劣性遺伝型パーキンソン病(PD)の原因遺伝子として同定された.PINK1蛋白はミトコンドリアに局在するリン酸化酵素と考えられ,おもに分子生物学・細胞生物学的手法によりPINK1蛋白に関する機能解析が行われてきた.本蛋白の機能低下によるミトコンドリアの呼吸機能障害,ミトコンドリアのカルシウム(Ca)ホメオスタシスの異常,ミトコンドリアを含む酸化ストレス上昇などが報告されている.近年では,PINK1とミトコンドリアダイナミクスとの関連や,ミトコンドリア内膜電位維持との関係が指摘されている.さらに,別の劣性遺伝型PD遺伝子産物Parkinと協調し,不要となったミトコンドリアのautophagyによる処理(mitophagy)に関与している可能性も報告されている.したがって,PINK1遺伝子はPDとミトコンドリアという観点から注目されている.本稿ではこの約10年間の研究の流れを概説し,主だった仮説を紹介する.
【北田 徹:PINK1蛋白とミトコンドリア. 医学のあゆみ vol.247 1031-1037 2013】
私の感想:
難しすぎてコメント不可です。
詳細は↓
https://www.ishiyaku.co.jp/magazines/ayumi/AyumiArticleDetail.aspx?BC=924710&AC=13365
AD患者さんにおける感覚器の障害 [アルツハイマー病]
AD患者さんにおける感覚器の障害
周辺視野の問題があって、運転中の事故を起こしやすくなることが指摘されています。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第9回『認知症の中核症状に関する理解を深めましょう─視空間機能障害』(2012年12月20日公開)
3番目は視空間機能障害です。従来の基準で、「失認」・「失行」とされた所見が視空間機能障害としてまとめられました。
地理的障害(地誌的見当識障害)には街並失認(視覚性失認の一型)と道順障害(視空間失認の一型)があります。街並失認とは、街並(建物・風景)の同定障害であり、周囲の風景が道をたどるうえでの目印にならないために道に迷ってしまいます。
自宅付近で道に迷うアルツハイマー病患者の病態としては、少なくとも初期には「道順障害」的な要素が大きいようです(高橋伸佳:街を歩く神経心理学 医学書院, 東京, 2009, pp152-153)。
失認のある患者さんにおいては、お風呂の入り口に床の色と違うバスマットが敷いてあると、バスマットの部分が谷底のように見えてしまい、患者さんは「落ちてしまう」と感じ、渡れない(足が踏み出せない)と訴える現象が出現することもあります。このような症状を呈した場合には、バスマットをどける(谷底をなくす)か、床の色と同じ色のバスマットにするなどの対応が効果的です。
また、視空間機能障害が出現してくると、車庫入れで車を擦ってしまうなどの影響も出てきます。
失行とは、運動障害はなく、手や足が動くのに、まとまった動作や行為ができないことです。挨拶ができないとか、箸などの道具が使えない(箸を渡しても食事を摂取する動作ができない)、使い慣れた電化製品の使用がわからない、図形がうまく書けないなどの不都合が生じます。そのため、日常生活にも差し障りが出てきます。
1995年に46歳で若年性認知症と診断されたクリスティーンさんは、視空間機能障害に絡んで以下のように語っています(一部改変)。
「世界はグラグラした場所に感じられ、その空間の中で自分の体の各部分がどこにあるのかがわかりづらくなる。
液体の入ったコップをこぼさずに持つには大変な努力がいる。コップを見て、自分の体を見て、体がどうなっているか注意しなければならない…。こんな一見単純な作業にも、無数の動作と反応がある。私にとって、飲み物を運ぶのは相当難しい仕事になってしまった。私の体の各部分はどこにあるのか? コップはどこか? どうして注意して見ていないと中の液体がピチャピチャ跳ねるのか? どうしてテーブルの向こうへ運ぶ途中で突然物にぶつかってしまうのか? どうして手を伸ばすと物をひっくり返してシミをつくってしまうのか?
それはちょうど競馬馬の目隠しをつけてトンネルをのぞいているような感じだ。周辺視野は狭くなり、まわりではっきりとした動きがあると、私はすぐにビクッと驚いてしまい、それまでの行動をじゃまされてしまう。まるでウインカーが点滅し続けているみたいだ。鏡の前を通ると、部屋の中に自分と一緒に知らない人がいると思って、跳び上がってしまうこともあるほどだ!
台所や浴室では、よく物をひっくり返す。距離の判断を間違えて、物にぶつかってしまうのだ。模様に惑わされることもある。表面が滑らかでも模様のある床を歩くと、つまづいてしまうことがある。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp132-133)
「私たちの不安が増大するひとつの理由は、道がわからない、自分が今いるところがわからないということだ。頭の中の地図をなくしたか、そうでなくとも、地図と自分の周囲の現実とが結びつかなくなってしまったようになる。だから自分の家のまわりの見慣れたところでない限り、誰かに道を案内してもらわなければならない。
2000年5月、私はカウンセリング学位コースの一環として、バサーストの大学の寮にひとりで行った。それはまさに悪夢だった。寮からわずか50メートルほどしか離れていない学生食堂や講義室へ行く道がわからないのだ。とにかく見覚えのある顔(もちろん「名前」ではない─名前なんてまったくわからなかったのだから)の人のあとについて行くしかなかった。ケアパートナーの案内なしに、ひとりで知らないところへ行こうとしたのは、あの時が最後になった。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p152)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第138回『認知症のケア どうしたらもっとうまく意思疎通できるのか』(2013年5月12日公開)
クリスティーンさんは、ゴールドスミスの本に記載されている記述(Goldsmith M:Hearing the voice of people with dementia, Jessica Kingsley Publishers, London, 1996, pp58-59)を引用し、どうすれば認知症のある人たちともっとうまく意思疎通できるかを紹介しています(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp190-191)。以下に列記致します。
・ゆったりした環境をつくる。
・穏やかな、自信に満ちた、気さくな態度をとる。
・その人の視野の内に入り、同じ目の高さで目を合わせたまま、名前を言う。
・その人がいやがらない範囲内で身体にふれる。
・簡単な言葉でゆっくりと、敬意をもって話す。
・理解する時間を与える。
・聞き上手になって、言葉がつかえてもじっと待ち、言葉の裏にある意味を察する。
・あいまいな言い方を避け、短い文章を使う。
・できれば写真などを使って、言っていることを具体的に説明する。
・話について行くように努力し、言い間違いを直したり、不適切な返答を笑ったりしない。
・よくできた時はほめる。
・感情をむきだしにされても、あわてない。
「その人の視野の内に入り、同じ目の高さで目を合わせたまま、名前を言う」という事項に関連して、アルツハイマー病(AD)患者さんにおける視野についての興味深い記述をご紹介しておきましょう。
「ADで、どのような感覚器の障害が起こるかは十分明らかにはなっていませんが、一般的には、視覚、ついで聴覚などの系統発生学的に新しい感覚器の機能から低下すると考えられています。
人間は、外界の情報を得るために80%以上を視覚に頼って生活している生き物だといわれており、認知症が進行すると、視覚の障害に配慮する必要があります。
人間の視野は上下150度、左右200度の範囲に及びますが、私たちは物を注視するとき、網膜の黄斑部のなかにある直径1.85mmの中心窩でほとんどの情報を得ています。この視神経が集中している中心窩を用いて、多くの情報が得られるのは、視野の中心から5度の視野の範囲だといわれています。視野の中心から10度になると情報量は5分の1に、20度に広がると情報量は10分の1にまで低下します。
進行した認知症の方では、なおさら視野の真ん中に必要な情報がないと感知することができません。常にその人の正面に必要な情報が来るように留意します。本人の身体介護の場面でも、真正面から声掛けをしながら近づかなければなりません。」(平原佐斗司編著:認知症ステージアプローチ入門─早期診断、BPSDの対応から緩和ケアまで 中央法規, 東京, 2013, p28)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第231回『注目される自動車運転の問題─視野が次第に狭くなる』(2013年8月18日公開)
『アルツハイマーのための新しいケア─語られなかった言葉を探して』(阿保順子監訳 誠信書房 2007)を読みますと、著者のジョアン・コーニグ・コステさんと夫(40歳代で発症し、1976年死去)の「認知症の世界への旅立ちは、サポートグループもなければマニュアルや指標一つなかった1971年に始まった」(同書p4)と書かれています。全米アルツハイマー病協会が設立(1980年)される約10年も前のことです。
指南書の類が全くなかった時代に、細やかな観察力から「ハビリテーションの五つの鍵」を独自に考案し実践した行動力は本当に驚きです。
「五つの鍵」の4番目である「患者の世界に生きる」とはどういうことでしょうか。「言い返したり叱咤せず、患者の視点で物事をみる。患者の今いる『場所』と『時』を共有し、そのなかでお互いに喜びを見いだす」(同書p9)ことです。多くの介護本が広く出回っている今日でさえ、介護者が「叱らない介護」に到達するまでには長い年月を要する現状を思えば、ジョアンさんの感性の鋭さは容易に窺い知ることができますね。
シリーズ第138回『認知症のケア どうしたらもっとうまく意思疎通できるのか』(http://apital.asahi.com/article/kasama/2013050200010.html)においてご紹介しましたように、人間の視野は上下150度、左右200度の範囲に及びますが、私たちは物を注視するとき、網膜の黄斑部のなかにある直径1.85mmの中心窩でほとんどの情報を得ています。この視神経が集中している中心窩を用いて、多くの情報が得られるのは、視野の中心から5度の視野の範囲だといわれています。視野の中心から10度になると情報量は5分の1に、20度に広がると情報量は10分の1にまで低下します。進行した認知症の方では、なおさら視野の真ん中に必要な情報がないと感知することができない(平原佐斗司編著:認知症ステージアプローチ入門─早期診断、BPSDの対応から緩和ケアまで 中央法規, 東京, 2013, p28)のでしたね。
運転能力に特に大きく関与するのが「有効視野」とされています。「自動車運転の場合に限らず、視覚認知は周辺視によって次の注視すべき対象を検出した後、それを中心視で詳しく確認し、また次の対象物を検出するという作業の繰り返しである。この周辺視のうち、認知に寄与する部分が有効視野に該当する。有効視野という概念はMackworthにより、『ある視覚課題の遂行中に、注視点の周りで情報が瞬間的に蓄えられ、読み出される部分』と定義されている。視力、視野、コントラスト感度、有効視野、認知機能などと事故との関連を検討した結果、交通事故を予測する上で最も予測力が高いものは有効視野であった。」(一部改変)と報告されています(藤田佳男:有効視野を用いた運転能力評価法について教えてください. Geriatric Medicine Vol.50 179-181 2012)。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第232回『注目される自動車運転の問題─競馬馬の目隠しをつけてトンネルをのぞく感じ』(2013年8月19日公開)
「有効視野」と聞きますと、私は、眼球運動異常とアルツハイマー病との関係を研究した報告(http://lib.nagaokaut.ac.jp/kiyou/data/study/k24/K24_8.pdf)を思い出します。
特定のターゲットの探索に関与しているのは、前頭眼野という部位です(ダーリア・W・ザイデル:芸術的才能と脳の不思議─神経心理学からの考察 河内十郎監訳,河内薫訳 医学書院, 2010, p189)。
若年性認知症を患ったクリスティーンさんは、視野の制限について以下のように語っています。
「競馬馬の目隠しをつけてトンネルをのぞいているような感じだ。周辺視野は狭くなり、まわりではっきりとした動きがあると、私はすぐにビクッと驚いてしまい、それまでの行動をじゃまされてしまう。まるでウインカーが点滅し続けているみたいだ。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p132)
また、クリスティーンさんは、車を運転することの難しさについても言及しております(一部改変)。
「あなたに認知症があって、まだ車の運転をしているならば、いつまでそんなふうに人に頼らずにやっていけるのかと考えるだろう。ちょっと車が接触しただけでも、みんなから認知症のせいにされないだろうかと心配になる。車の運転をあきらめることは、認知症の人とその家族にとって、深い心の傷になる。現在、私は緊急時だけ運転することにしているが、我が家のある静かな田舎でも、家から二つ三つ通りを行くだけで私はとても不安になる。不測の事態に対して絶対に素早く反応できないと思うし、目先の道路に焦点を定めて集中するのはとても難しい。さらには、すべてのペダル、レバー、文字盤、ライトを覚えて、それらがどう動くのか、何のためのものか、そして自分が次にすべきことは何なのか、覚えておかなくてはならないのは大変なことなのだ。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp133-134)
では、有効視野が低下してくるとどのような交通事故を起こしやすくなってくるのでしょうか。
「通常、我々は運転中、視線を向けて網膜の中心で事物を捉える中心視とその周辺の情報にも注意を配る周辺視との両者を同時並行している。有効視野(Useful Field of View;UFOV)検査では、中心視と同時に意識でき、すばやい課題反応に活かされる周辺視野の範囲(有効視野)を評価する。Clayらによるメタ分析では、UFOV検査と否定的な運転行動の生起との関連が十分な効果量をもって(Cohen's d=0.95)示されている。高齢者では若齢者に比べて、放射方向へ周辺距離が増すにつれてUFOV課題の成績が低下する有効視野の狭隘が生じる。こうした有効視野の狭隘を本質とした視空的注意の障害は、交差点で出会い頭に衝突する事故が多いとされる高齢運転者一般の危険運転をよく説明するものであり、エビデンスも蓄積されている。」(河野直子:認知機能低下と運転適性:一般及び軽度認知障害の高齢運転者を対象とした研究動向. Dementia Japan Vol.27 191-198 2013)
メモ:Cohen's d
2グループの平均値の差を比較するt検定という手法があります。この手法では、効果量(Effect Size)として、dという指標を使います。dが0.2より大きいとき効果量は小さい(small)と言い、dが0.5より大きいとき効果量は中くらい(medium)と言い、dが0.8より大きいとき効果量は大きい(large)と言います(http://www.mizumot.com/method/mizumoto-takeuchi.pdf)。
周辺視野の問題があって、運転中の事故を起こしやすくなることが指摘されています。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第9回『認知症の中核症状に関する理解を深めましょう─視空間機能障害』(2012年12月20日公開)
3番目は視空間機能障害です。従来の基準で、「失認」・「失行」とされた所見が視空間機能障害としてまとめられました。
地理的障害(地誌的見当識障害)には街並失認(視覚性失認の一型)と道順障害(視空間失認の一型)があります。街並失認とは、街並(建物・風景)の同定障害であり、周囲の風景が道をたどるうえでの目印にならないために道に迷ってしまいます。
自宅付近で道に迷うアルツハイマー病患者の病態としては、少なくとも初期には「道順障害」的な要素が大きいようです(高橋伸佳:街を歩く神経心理学 医学書院, 東京, 2009, pp152-153)。
失認のある患者さんにおいては、お風呂の入り口に床の色と違うバスマットが敷いてあると、バスマットの部分が谷底のように見えてしまい、患者さんは「落ちてしまう」と感じ、渡れない(足が踏み出せない)と訴える現象が出現することもあります。このような症状を呈した場合には、バスマットをどける(谷底をなくす)か、床の色と同じ色のバスマットにするなどの対応が効果的です。
また、視空間機能障害が出現してくると、車庫入れで車を擦ってしまうなどの影響も出てきます。
失行とは、運動障害はなく、手や足が動くのに、まとまった動作や行為ができないことです。挨拶ができないとか、箸などの道具が使えない(箸を渡しても食事を摂取する動作ができない)、使い慣れた電化製品の使用がわからない、図形がうまく書けないなどの不都合が生じます。そのため、日常生活にも差し障りが出てきます。
1995年に46歳で若年性認知症と診断されたクリスティーンさんは、視空間機能障害に絡んで以下のように語っています(一部改変)。
「世界はグラグラした場所に感じられ、その空間の中で自分の体の各部分がどこにあるのかがわかりづらくなる。
液体の入ったコップをこぼさずに持つには大変な努力がいる。コップを見て、自分の体を見て、体がどうなっているか注意しなければならない…。こんな一見単純な作業にも、無数の動作と反応がある。私にとって、飲み物を運ぶのは相当難しい仕事になってしまった。私の体の各部分はどこにあるのか? コップはどこか? どうして注意して見ていないと中の液体がピチャピチャ跳ねるのか? どうしてテーブルの向こうへ運ぶ途中で突然物にぶつかってしまうのか? どうして手を伸ばすと物をひっくり返してシミをつくってしまうのか?
それはちょうど競馬馬の目隠しをつけてトンネルをのぞいているような感じだ。周辺視野は狭くなり、まわりではっきりとした動きがあると、私はすぐにビクッと驚いてしまい、それまでの行動をじゃまされてしまう。まるでウインカーが点滅し続けているみたいだ。鏡の前を通ると、部屋の中に自分と一緒に知らない人がいると思って、跳び上がってしまうこともあるほどだ!
台所や浴室では、よく物をひっくり返す。距離の判断を間違えて、物にぶつかってしまうのだ。模様に惑わされることもある。表面が滑らかでも模様のある床を歩くと、つまづいてしまうことがある。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp132-133)
「私たちの不安が増大するひとつの理由は、道がわからない、自分が今いるところがわからないということだ。頭の中の地図をなくしたか、そうでなくとも、地図と自分の周囲の現実とが結びつかなくなってしまったようになる。だから自分の家のまわりの見慣れたところでない限り、誰かに道を案内してもらわなければならない。
2000年5月、私はカウンセリング学位コースの一環として、バサーストの大学の寮にひとりで行った。それはまさに悪夢だった。寮からわずか50メートルほどしか離れていない学生食堂や講義室へ行く道がわからないのだ。とにかく見覚えのある顔(もちろん「名前」ではない─名前なんてまったくわからなかったのだから)の人のあとについて行くしかなかった。ケアパートナーの案内なしに、ひとりで知らないところへ行こうとしたのは、あの時が最後になった。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p152)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第138回『認知症のケア どうしたらもっとうまく意思疎通できるのか』(2013年5月12日公開)
クリスティーンさんは、ゴールドスミスの本に記載されている記述(Goldsmith M:Hearing the voice of people with dementia, Jessica Kingsley Publishers, London, 1996, pp58-59)を引用し、どうすれば認知症のある人たちともっとうまく意思疎通できるかを紹介しています(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp190-191)。以下に列記致します。
・ゆったりした環境をつくる。
・穏やかな、自信に満ちた、気さくな態度をとる。
・その人の視野の内に入り、同じ目の高さで目を合わせたまま、名前を言う。
・その人がいやがらない範囲内で身体にふれる。
・簡単な言葉でゆっくりと、敬意をもって話す。
・理解する時間を与える。
・聞き上手になって、言葉がつかえてもじっと待ち、言葉の裏にある意味を察する。
・あいまいな言い方を避け、短い文章を使う。
・できれば写真などを使って、言っていることを具体的に説明する。
・話について行くように努力し、言い間違いを直したり、不適切な返答を笑ったりしない。
・よくできた時はほめる。
・感情をむきだしにされても、あわてない。
「その人の視野の内に入り、同じ目の高さで目を合わせたまま、名前を言う」という事項に関連して、アルツハイマー病(AD)患者さんにおける視野についての興味深い記述をご紹介しておきましょう。
「ADで、どのような感覚器の障害が起こるかは十分明らかにはなっていませんが、一般的には、視覚、ついで聴覚などの系統発生学的に新しい感覚器の機能から低下すると考えられています。
人間は、外界の情報を得るために80%以上を視覚に頼って生活している生き物だといわれており、認知症が進行すると、視覚の障害に配慮する必要があります。
人間の視野は上下150度、左右200度の範囲に及びますが、私たちは物を注視するとき、網膜の黄斑部のなかにある直径1.85mmの中心窩でほとんどの情報を得ています。この視神経が集中している中心窩を用いて、多くの情報が得られるのは、視野の中心から5度の視野の範囲だといわれています。視野の中心から10度になると情報量は5分の1に、20度に広がると情報量は10分の1にまで低下します。
進行した認知症の方では、なおさら視野の真ん中に必要な情報がないと感知することができません。常にその人の正面に必要な情報が来るように留意します。本人の身体介護の場面でも、真正面から声掛けをしながら近づかなければなりません。」(平原佐斗司編著:認知症ステージアプローチ入門─早期診断、BPSDの対応から緩和ケアまで 中央法規, 東京, 2013, p28)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第231回『注目される自動車運転の問題─視野が次第に狭くなる』(2013年8月18日公開)
『アルツハイマーのための新しいケア─語られなかった言葉を探して』(阿保順子監訳 誠信書房 2007)を読みますと、著者のジョアン・コーニグ・コステさんと夫(40歳代で発症し、1976年死去)の「認知症の世界への旅立ちは、サポートグループもなければマニュアルや指標一つなかった1971年に始まった」(同書p4)と書かれています。全米アルツハイマー病協会が設立(1980年)される約10年も前のことです。
指南書の類が全くなかった時代に、細やかな観察力から「ハビリテーションの五つの鍵」を独自に考案し実践した行動力は本当に驚きです。
「五つの鍵」の4番目である「患者の世界に生きる」とはどういうことでしょうか。「言い返したり叱咤せず、患者の視点で物事をみる。患者の今いる『場所』と『時』を共有し、そのなかでお互いに喜びを見いだす」(同書p9)ことです。多くの介護本が広く出回っている今日でさえ、介護者が「叱らない介護」に到達するまでには長い年月を要する現状を思えば、ジョアンさんの感性の鋭さは容易に窺い知ることができますね。
シリーズ第138回『認知症のケア どうしたらもっとうまく意思疎通できるのか』(http://apital.asahi.com/article/kasama/2013050200010.html)においてご紹介しましたように、人間の視野は上下150度、左右200度の範囲に及びますが、私たちは物を注視するとき、網膜の黄斑部のなかにある直径1.85mmの中心窩でほとんどの情報を得ています。この視神経が集中している中心窩を用いて、多くの情報が得られるのは、視野の中心から5度の視野の範囲だといわれています。視野の中心から10度になると情報量は5分の1に、20度に広がると情報量は10分の1にまで低下します。進行した認知症の方では、なおさら視野の真ん中に必要な情報がないと感知することができない(平原佐斗司編著:認知症ステージアプローチ入門─早期診断、BPSDの対応から緩和ケアまで 中央法規, 東京, 2013, p28)のでしたね。
運転能力に特に大きく関与するのが「有効視野」とされています。「自動車運転の場合に限らず、視覚認知は周辺視によって次の注視すべき対象を検出した後、それを中心視で詳しく確認し、また次の対象物を検出するという作業の繰り返しである。この周辺視のうち、認知に寄与する部分が有効視野に該当する。有効視野という概念はMackworthにより、『ある視覚課題の遂行中に、注視点の周りで情報が瞬間的に蓄えられ、読み出される部分』と定義されている。視力、視野、コントラスト感度、有効視野、認知機能などと事故との関連を検討した結果、交通事故を予測する上で最も予測力が高いものは有効視野であった。」(一部改変)と報告されています(藤田佳男:有効視野を用いた運転能力評価法について教えてください. Geriatric Medicine Vol.50 179-181 2012)。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第232回『注目される自動車運転の問題─競馬馬の目隠しをつけてトンネルをのぞく感じ』(2013年8月19日公開)
「有効視野」と聞きますと、私は、眼球運動異常とアルツハイマー病との関係を研究した報告(http://lib.nagaokaut.ac.jp/kiyou/data/study/k24/K24_8.pdf)を思い出します。
特定のターゲットの探索に関与しているのは、前頭眼野という部位です(ダーリア・W・ザイデル:芸術的才能と脳の不思議─神経心理学からの考察 河内十郎監訳,河内薫訳 医学書院, 2010, p189)。
若年性認知症を患ったクリスティーンさんは、視野の制限について以下のように語っています。
「競馬馬の目隠しをつけてトンネルをのぞいているような感じだ。周辺視野は狭くなり、まわりではっきりとした動きがあると、私はすぐにビクッと驚いてしまい、それまでの行動をじゃまされてしまう。まるでウインカーが点滅し続けているみたいだ。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p132)
また、クリスティーンさんは、車を運転することの難しさについても言及しております(一部改変)。
「あなたに認知症があって、まだ車の運転をしているならば、いつまでそんなふうに人に頼らずにやっていけるのかと考えるだろう。ちょっと車が接触しただけでも、みんなから認知症のせいにされないだろうかと心配になる。車の運転をあきらめることは、認知症の人とその家族にとって、深い心の傷になる。現在、私は緊急時だけ運転することにしているが、我が家のある静かな田舎でも、家から二つ三つ通りを行くだけで私はとても不安になる。不測の事態に対して絶対に素早く反応できないと思うし、目先の道路に焦点を定めて集中するのはとても難しい。さらには、すべてのペダル、レバー、文字盤、ライトを覚えて、それらがどう動くのか、何のためのものか、そして自分が次にすべきことは何なのか、覚えておかなくてはならないのは大変なことなのだ。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, pp133-134)
では、有効視野が低下してくるとどのような交通事故を起こしやすくなってくるのでしょうか。
「通常、我々は運転中、視線を向けて網膜の中心で事物を捉える中心視とその周辺の情報にも注意を配る周辺視との両者を同時並行している。有効視野(Useful Field of View;UFOV)検査では、中心視と同時に意識でき、すばやい課題反応に活かされる周辺視野の範囲(有効視野)を評価する。Clayらによるメタ分析では、UFOV検査と否定的な運転行動の生起との関連が十分な効果量をもって(Cohen's d=0.95)示されている。高齢者では若齢者に比べて、放射方向へ周辺距離が増すにつれてUFOV課題の成績が低下する有効視野の狭隘が生じる。こうした有効視野の狭隘を本質とした視空的注意の障害は、交差点で出会い頭に衝突する事故が多いとされる高齢運転者一般の危険運転をよく説明するものであり、エビデンスも蓄積されている。」(河野直子:認知機能低下と運転適性:一般及び軽度認知障害の高齢運転者を対象とした研究動向. Dementia Japan Vol.27 191-198 2013)
メモ:Cohen's d
2グループの平均値の差を比較するt検定という手法があります。この手法では、効果量(Effect Size)として、dという指標を使います。dが0.2より大きいとき効果量は小さい(small)と言い、dが0.5より大きいとき効果量は中くらい(medium)と言い、dが0.8より大きいとき効果量は大きい(large)と言います(http://www.mizumot.com/method/mizumoto-takeuchi.pdf)。
笠間 睦:メマンチンによるアルツハイマー病の中核症状に対する効果判定の試み─MoCA-Jを用いて─. Geriatric Medicine Vol.51 723-727 2013 [アルツハイマー病]

語り 040
─最初に「どうも自分は人の名前を忘れたりして変だな」って思ってから、今日まで、忘れやすさに何か変化はありますか?
「だんだん忘れるようになったな」とは思うてたんですけども、メマリーっちゅう薬を飲まんようになったら、急に、忘れることが多くなった。検査の
結果、やめたほうがいいんじゃないかっちゅうことで、もうお薬を出してもらえやんようになったんです。
─お薬を出してもらえなくなったことについて、どう思いましたか?
そのときはそんなにもの忘れがひどくなるとは思いませんだもんで、あれですけど……。考えてみたら、あのお薬が今まで効いとったんかなと思う。
─そのお薬をやめて、「もの忘れが前よりもひどくなったな」って思うのは、お薬を飲んでいるときは「調子がよくなったな。前よりも忘れなくなったな」っていう感覚はあったんですね。
薬を飲んどると、それ〔もの忘れの進み方〕が遅なるちゅうか……。よくなったとは感じません。治る薬じゃないもんで。そでけんども、薬がなくなってから気がつきました、今まではあの薬のおかげやったなって。それ飲んでなかったら、もっとずっとその先がひどくなってたかもわかりませんわね。
本人12(プロフィール:p.613)
【認知症の語り─本人と家族による200のエピソード. 健康と病いの語りディペックス・ジャパン, 東京, 2016, pp111-112】
私の感想:
メマンチン(メマリー
メマンチンの中核症状に対する効果をsevere impairment battery(SIB)で評価(国内第Ⅲ相試験-IE3501)したところ、4つの領域(言語,注意,実行,視空間能力)で有意な改善を認めております。
要するに、注意機能が向上し記憶が良くなったように感じるのです。
詳細は、私の論文(『老年医学』2013)に記載されておりますのでご参照下さい。
笠間 睦:メマンチンによるアルツハイマー病の中核症状に対する効果判定の試み─MoCA-Jを用いて─. Geriatric Medicine Vol.51 723-727 2013
はじめに
認知症における最大のリスクは「加齢」とされており,超高齢社会の到来とともに,認知症,特にアルツハイマー病は「ありふれた疾患」の1つになってきている.このような時代を背景として,対症治療ではあるが4種類のアルツハイマー型認知症治療薬が汎用されるようになった.そのため,認知症専門医だけでなくかかりつけ医が認知症診療に積極的に関わっていくことが求められている.
しかしながら,奈良市においてかかりつけ医300人を対象として実施されたアンケート調査で,認知症治療の問題点として,実にかかりつけ医の52.8%が「薬の効果がはっきりしない」と回答している1).その理由は明らかでないが,プラセボ効果2)・ノセボ効果3)の影響,効果判定方法の相違なども一因と考えられる.実際に,個々の症例で認知症の程度や内容,進行速度は異なっており,治療開始前からの効果判定ポイントが明確でなかったりすることも一因となろう.
そこで筆者は,かかりつけ医がその効果を実感できるような指標の導入が必要と考え,日常臨床の現場でも実施可能な評価方法として,改訂長谷川式認知症スクリーニングテスト(HDS-R)とともに日本語版モントリオール認知評価検査(Montreal Cognitive Assessment:MoCA-J)を用いてアルツハイマー病患者における中核症状の評価を試みた.MoCA-Jは,多領域の認知機能(注意機能,集中力,実行機能,記憶,言語,視空間認知,概念的思考,計算,見当識)について,約10分という短い時間で評価することが可能である4).
なお,今回用いた治療薬はメマンチンであり,その中核症状に対する効果としては,severe impairment battery(SIB)で領域別認知機能を評価(国内第Ⅲ相試験-IE3501)したところ,4つの領域(言語,注意,実行,視空間能力)で有意な改善が認められている5).しかし,SIBによる評価を多忙な日常診療の現場で定期的に実施することは困難であり,メマンチンによる中核症状の改善を客観的に捉えにくい要因の1つとなっている.
以上の理由から,MoCA-Jを用いてアルツハイマー病の中核症状に対するメマンチンの効果判定を試みた.
対象と方法
対象は2013年1~2月に榊原白鳳病院物忘れ外来を受診してアルツハイマー病と診断され,メマンチン投与を開始した連続5症例(年齢:50歳代1例,70歳代4例,性別:男1例,女4例)である.なお,アルツハイマー病の診断はDSM-Ⅳに基づいて行った.これらの臨床像(教育歴,既往歴,治療歴,合併症,併用薬,現病歴,生活歴,ADL,認知症の行動・心理症状[behavioral and psychological symptoms of dementia:BPSD]の有無・程度など)を医療面接で聴取後,本研究について説明し,同意を得て,メマンチンを所定の用量,用法で投与した.メマンチン投与前および投与後4週目(ChEIとの併用例においては8週目)に日本語版MoCA-Jを実施し,中核症状に対するメマンチンの効果を評価した.なお,メマンチンの維持量に関しては,副作用がみられない限り20mgまで増量した.
結果
1.対象の臨床像
今回の5例は,全例ともにChEI(ドネペジル,ガランタミン,リバスチグミン)による治療を受けていた.しかし,その治療効果を実感できず筆者の物忘れ外来を受診した経緯である.
ChEIによる治療期間は,8~31カ月(平均20カ月)であった.
5例全例において,記銘記憶障害が認められている.
なお,5例のクレアチニンクリアランス推定値(Cockcroft-Gault計算式による)は,42mL/min,74mL/min,71mL/min,91mL/min,59mL/minであり,30mL/min以下の症例はなく腎機能は全例において正常である.
事例1から5のプロフィールを以下に簡単に紹介する.
【事例1 79歳女性 教育歴:9年】
夫と2人暮らし.娘2人が近隣に住んでおり,通院の際には付き添いとして来院している.
70歳まで経理の仕事に従事(最後の15年間は取締役を務めた).
X-3年,道順障害が出現してきた.X-2年になると手の込んだ料理が困難となってきた.
X年,もの忘れが目立つようになり,易刺激性および夫に対する暴言も出現してきたため当院を初診.道順障害のため,1人で外出すると目的地にたどり着けないことが目立つ状況である.また,居住区内にある公共のコピー機の使い方が分からず,カッとなって叩いて壊してしまい,居住区で問題となったことがある.夫が運転する車に同乗して買い物に行き,料理は本人が作ってはいるものの,連日のように煮物料理ばかりが続く状況である.
ガランタミンにて8カ月治療したものの期待した効果が認められず,メマンチンを併用開始とした.
【事例2 59歳女性 教育歴:12年】
若年発症のアルツハイマー型認知症である.夫と2人暮らし.子供2人は社会人となって家を出ている.同一敷地内に義父母が住んでいる.
X-3年,仕事の間違いが多くなり退職勧奨され郵便局を辞めている.X-2年になると料理をほとんどしなくなり,同一敷地内に住む義母が煮物などを作り持参する状況となった.精査目的にて神経内科を受診したところ,初診日に意に反して病名告知を受け,医師との相性が合わなかったことから,それ以降は近くのかかりつけ医にてドネペジル5mg(ジェネリック)を処方されてきた.
知人の勧めにより,X年に当院を初診.夫から聴取した話によると,最近は火の消し忘れが多くなり,不慣れな場所に出掛けると家に帰れない状況である.また,視空間機能障害のためか車庫入れの際にしばしばガレージに接触するようになり,車の運転は控えるようになっている.
目立ったBPSDは認められておらず,現状においては介護保険は申請していない.
【事例3 76歳女性 教育歴:12年】
夫と2人暮らし.X-1年11月,孫を連れて息子夫婦と家族旅行をした際に,前日にした話と全く同じ話をまるで初めてのように話していることに息子が気づいた.X-1年12月,親戚から預かった孫へのプレゼントを持参する約束を忘れていたため本人に確認すると,プレゼントは預かっていないと言い張ることがあった.また前日と同じメニューの料理が出てくるようにもなり,息子がメール医療相談を通して筆者に相談を寄せて,X年1月に当院を初診.ドネペジル5mgにて1年間治療を続けたものの期待した効果が認められず,易刺激性も認められるためメマンチンの併用を開始した.
【事例4 75歳男性 教育歴:12年】
妻と2人暮らし.
高校卒業後,航空自衛隊に入隊した.自衛隊においては教官も務め,55歳にて定年退職.その後,民間の会社に5年間勤め,60歳にて退職している.
X-2年に,かかりつけ医にてアルツハイマー型認知症と診断を受け,ドネペジル5mg(ジェネリック)を処方されている.
記銘記憶障害が徐々に進行しており,精査目的にてX年10月に当院を初診.前医の診断は正しいことを告げ,アルツハイマー型認知症の自然経過について説明し,ドネペジル5mgの服薬を続けて経過をみるように勧めた.
X+1年1月になると,入浴したことを忘れて風呂に入っていないと言ったり,食事をしたことを忘れて食べていないと言うことがしばしば出現してきた.また,毎日訪問していた息子や娘の家がどこか分からないといった状況も出現し,アパシーも目立つため再診となった.HDS-Rが初診時よりも4点悪化しており,易刺激性も認められるためメマンチンを併用開始するとともに,介護保険の申請も勧めた(要介護1と認定された).
【事例5 79歳女性 教育歴:12年】
夫が亡くなってから独居生活であり子供はいない.70歳まで種々のパート勤務をこなしていた.近くに住む妹が車を運転し買い物に連れ出してくれており,また,1日置きに宅配の弁当を頼んで何とか1人暮らしを続けている.
X-1年頃より,物忘れと喚語困難(語想起障害)が目立つようになってきた.X年に,精査目的にて当院を初診.アルツハイマー型認知症と診断し,ドネペジル5mgによる治療を開始した.
X+3年,リバーミード行動記憶検査(RBMT)の標準プロフィール点(24点満点)・スクリーニング点(12点満点)が両者ともに0点になり,作業療法士からはドネペジルの服薬忘れが目立っているとの情報が入り,メマンチンの併用を開始した.
本例においては,BPSDは目立たないものの,数分おきに同じ質問を繰り返すため,近所に住む兄弟にとっては介護負担を感じる大きな要因となっている.介護保険も申請しており,要支援1と認定されている.
2.メマンチン投与後の経過
メマンチンの維持量に関しては,副作用がない限り20mgまで増量することを基本としているが,事例1においては15mgの段階にてめまい感を訴えたため,維持量を10mgとして検討した.5例中3例(事例1,3,4)では,BPSD(易刺激性・情緒不安定)のために家族が介護面で苦慮していたが,メマンチン投与により2例(事例1,3)においてBPSDの軽減・消失を認めた.
今回の5例においては,メマンチン投与により臨床症状として言語障害,視空間機能障害,実行機能障害などの中核症状が改善したケースはなかった.
3.メマンチン投与前後のMoCA-Jの推移
メマンチン投与前後のMoCA-Jの推移を表1に示す.下位項目の点数変化に着目してみると,事例1・3・4においては視空間機能の改善が認められた.事例2・3においては言語機能の改善が認められており,事例3ではMoCA-Jが4点改善していた.また,事例4においては,注意機能の改善が認められている.
言語機能の語想起課題(11個以上で得点)の素点の変化に注目すると,事例1(11点→13点),事例2(6点→11点),事例3(8点→15点),事例4(14点→16点),事例5(4点→6点)といずれも点数は向上しており,臨床的な症状の改善としては捉えられないものの機能的には向上していることが示唆された.
一方で,視空間機能の点数が低下しているケース(事例5)も1例認められた.
考察
対象症例が極めて少ないがMoCA-Jを用いてアルツハイマー病の中核症状に対するメマンチンの効果判定を試みたところ,HDS-Rでは明らかでなかった効果がMoCA-Jで明らかにされた.その理由は効果判定基準による可能性もある.すなわち,長谷川によれば,HDS-R1~2点の小変化は施行時の状況差によっても発生するという.しかし,4~5点の差があれば,まず臨床的にも明らかな改善ないし悪化の所見に関連すると考えられることが報告されており6),本研究でもHDS-R4点以上を「改善」と判定しているからである.
ちなみに,筆者による2011年6月~2012年4月までにメマンチンを投与した連続23例の検討では,HDS-Rが4点以上改善したケースは4例(4/23:17.4%)あった.臨床症状として中核症状の改善が認められた4例のうち,HDS-Rが4点以上改善していたケースは1例のみであり,HDS-Rの改善と中核症状の改善との間には乖離が認められた7).記憶や見当識の評価項目が重視されているHDS-R,mini-mental state examination(MMSE)などの簡易認知機能検査では,メマンチンによる中核症状の改善を的確にとらえることは困難であるのかもしれない.
なお前述の23例の検討において,HDS-Rが4点以上改善した4例,臨床症状として中核症状の改善が認められた4例はいずれも,メマンチンの維持量が20mg/日であった.23例の中には,BPSDが改善した時点でメマンチンの漸増を中止した事例が6例,有害事象(傾眠および便秘)出現のため15mgから10mgに減量して維持した事例が1例,症状不変により家族の希望で中止した事例が1例含まれており,20mgまで増量した15例を対象として評価すると,中核症状の改善率(HDS-R≧4の改善)は26.7%(4/15)であった.なお,今回の5例の検討においては,HDS-Rが4点以上改善した事例はなかった.
一方,本研究のMoCA-Jによる評価では,視空間機能および言語機能がともに2点改善したことにより,点数が20点から24点へと4点改善した事例もあった.MoCAは,軽度アルツハイマー型認知症のスクリーニング検査として感度が高く,MoCA25点をカットオフ値とした場合の感度は100%と報告されている8).今回対象となった5症例においては,メマンチン投与前のMoCA-Jは全例20点以下であり,カットオフ値を5点以上下回る例が対象となっている.
以上より,MoCA-Jはかかりつけ医がアルツハイマー病の中核症状(特に言語,注意,実行,視空間能力)を評価し,メマンチンの投与前後で比較すれば,その効果を実感できる可能性があることが示唆された.
一般に,メマンチンの作用機序は,N-methyl-D-aspartate(NMDA)受容体拮抗作用により,神経細胞内への過剰なCaイオンの流入抑制による神経細胞保護効果と,シナプティックノイズの抑制による記憶・学習機能障害抑制作用である.国内第Ⅲ相試験(IE3501)におけるSIBのスコア変化量でも,投与4週後以降,メマンチンはプラセボ群に対して有意に進行を抑制していた5).また,メマンチンとドネペジルとを併用した場合には,投与4~8週後に効果が発現するとも報告されている9).
メマンチンはまた,NMDA受容体に対する非競合的拮抗作用によって,認知機能を損なうことなくBPSDに効果を示す10).特に,興奮・攻撃性,妄想,易刺激性・情緒不安定において有効性が高く,また,試験開始時には上記の症状を認めなかった患者群においても,メマンチン投与により後の症状発現率が有意に低下したことが報告されている11).
当院物忘れ外来においては,介護者ケアといった視点を重視して種々の取り組みを実施してきた12).介護者の話をじっくり傾聴していると,介護負担における最大の要因は,中核症状のもの忘れではなくBPSDであることを痛感する.認知症患者の介護者においては28~55%が抑うつ状態にあるとされ,その負担度を死亡リスクでみると,がん患者の介護者と比べてもなお高いことが報告されている13).
今後爆発的な増加が予想される認知症患者をできるかぎり地域でみていくためには,BPSDに対する対応強化が喫緊の課題である.この点で非定型抗精神病薬が認知症診療の現場において従来よく用いられてきた.しかしながら,非定型抗精神病薬の使用により死亡率が1.6~1.7倍高くなるとして,2005年にFDAが警告を発している.FDAは2008年には,認知症関連の高齢患者に対する定型・非定型抗精神病薬の使用は,ともに死亡リスク上昇と関連することを通知しており,米国においてはアルツハイマー病に対して禁忌となっている14).このような背景もあって,メマンチンによるBPSD改善への期待は高くなっているのが現状である.
結論
メマンチンによるBPSDの改善効果は肌で感じているものの,中核症状に対する効果を実感している臨床医はまだまだ少ないのが現状である.
MoCA-Jを日常診療において活用することにより,中核症状に対するメマンチンの効果をかかりつけ医が実感できる可能性が示唆された.今後さらに症例数を増やし,より詳細な検討を行いたいと考えている.
参考文献
1)本間 昭:認知症の人のために専門医ができること. 老年精医誌 2013;24(Suppl 1):133-138.
2)本間 昭:認知症患者にプラセボ効果が認められる理由. 日本医事新報 2011;No4573:56-57.
3)笠間 睦:臨床医からみたジェネリック医薬品─認知症治療. Prog Med 2013;33:1089-1092.
4)鈴木宏幸, 藤原佳典:Montreal Cognitive Assessment(MoCA)の日本語版作成とその有効性について. 老年精医誌 2010;21:198-202.
5)第一三共株式会社:医薬品インタビューフォーム メマリー錠
6)長谷川和夫:痴呆の重症度と長谷川式スケール得点. 日本医事新報 1997;No3817:114.
7)笠間 睦:認知症診療におけるメマンチンの位置づけ─自験23例の検討結果─. Prog Med 2013;33:311-315.
8)Nasreddine ZS et al:The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005;53:695-699.
9)Tariot PN et al:Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: a randomized controlled trial. JAMA 2004;291:317-324.
10)藤本健一:メマンチン. 日本臨牀 2011;69(Suppl 10):41-46.
11)Gauthier S et al:Effects of memantine on behavioural symptoms in Alzheimer's disease patients: an analysis of the Neuropsychiatric Inventory (NPI) data of two randomised, controlled studies. Int J Geriatr Psychiatry 2005;20:459-464.
12)笠間 睦:認知症介護者に対する終末期の意向調査. 日本医事新報 2011;No4566:26-29.
13)Christakis NA, Allison PD:Mortality after the hospitalization of a spouse. N Engl J Med 2006;354:719-730.
14)遠藤英俊:認知症の薬物療法の実際とその効果. 日医雑誌 2012;141:555-559.
アルツハイマー病─根本治療薬(疾患修飾薬) [アルツハイマー病]
https://www.facebook.com/atsushi.kasama.9/posts/603456106490739
これからのアルツハイマー病治験
こうして,臨床的に認知症を発症するより前,脳病変があまり進んでいない段階で治療を開始することが技術的に可能となり,AD病態修飾薬の治験はプレクリニカル期にある未発症AD例を対象とするようになった。Fig.4に示すように,その時期は,バイオマーカー所見の進行度から推測して,おそらく認知機能低下を自覚するMCIよりも前である必要があり,それはおそらく認知症発症の10~30年前であろうと考えられている。このことは治験にいくつかの困難を惹起する。プレクリニカル期AD例を標的とした治験において,単に認知機能正常高齢者を対象とし,エンドポイントを「認知症発症」に置くと,そのままでは,おそらく数千人規模の参加者と5~10年にわたる長期の観察期間を必要とすることになる。そこで現実的な対応として,何らかの方法で対象者をプレクリニカル期AD例に絞り込む,あるいは,少なくとも,プレクリニカル期ADの割合が一般的な認知機能正常高齢者よりもかなり高い集団を事前に用意することが求められる。
現在,Solanezumabを用いて行われている孤発性ADを標的とするA4治験では,PETによるアミロイドイメージングを実施し,陽性者を対象としているが,認知機能正常高齢者におけるアミロイドイメージング陽性者の割合を考慮すると,侵襲・コストの両面で,同様の治験を多数並行して,あるいは繰り返し実施するのは容易なことではない。API(Alzheimer's Prevention Initiative)の優性遺伝性ADの変異キャリア,あるいはApoE4ホモ例を対象とした治験,前述のDIANの延長であるDIAN-TU(trial unit)などでは,慎重な遺伝カウンセリングを含むスキームの構築が求められる。また,治験のエンドポイントを「認知症発症」に置くのではなく,アミロイドイメージングや脳脊髄液バイオマーカーの所見の変化をその代替とすることにより観察期間の短縮を図ることも考えられるが,それが可能かどうかを判断するには,ADNIなどのこれまでに積み重ねてきた厳密な観察研究のさらなる継続が必要である。
【秋山治彦:アルツハイマー病根本治療薬の開発. BRAIN and NERVE vol.68 463-472 2016】
私の感想:
孤発性ADを標的とするA4治験についてはアピタルにおいても記述しました。以下に再掲致します。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第93回『アルツハイマー病の治療薬 期待される根本治療薬』(2013年3月28日公開)
Preclinical ADに関しては、現時点では臨床現場での超早期診断を念頭に置いて提唱されているわけではなく、あくまでも臨床治験などの研究で用いることが前提となっています。
期待された多くの根本治療薬は、臨床試験において実薬群とプラセボ群との間に有意差が認められず治験が不成功に終わっています。根本治療薬の治験が成功しないことの要因として、「多くの研究者が心の中で思っていることの一つは、根本治療薬の投与時期が遅すぎるのではないか」(荒井啓行:序文─先制医療と認知症予防の展望─. 日本臨牀 Vol.69 Suppl8 1-6 2011)という点です。
初期ADであっても、アミロイドの蓄積と広範な神経細胞死が既に生じており、その段階で根本治療薬を投与しても遅いのではないかという考えに立って、「Preclinical AD」という概念が導入されてきたわけです。
東京都健康長寿医療センター研究所附属診療所の石井賢二医師は、Preclinical ADの研究を通して、アルツハイマー病の根本的な克服に向けた発症予防・遅延研究が進んでいくという大きな意義を認めつつも、臨床症状が認められなくとも病気(Preclinical AD)に組み入れることの問題点について言及しております(石井賢二:アミロイドイメージングの現状と有用性. 神経内科 Vol.77 597-605 2012)。
「まず第一に、preclinical ADという言葉が独り歩きすることの倫理的問題である。健常者におけるアミロイド陽性所見が発症のリスクとしての正確な評価が得られていないにもかかわらず、発症が運命づけられているかのように誤解されることは、新しい診断技術が普及する過程で起こりうることである。また、この検査結果が社会的『差別』を生む可能性も指摘されている。保険料が高くなったり、社会的地位から排除されたりする可能性がないとはいえない。リスクとしての評価が定まり、なんらかの発症遅延法が確立されるまでは、みだりに『検診』として用いるべきではないし、結果の開示や取り扱いについても十分な配慮が必要である。
第二点として、この診断基準のストーリーに乗らない症例を見出して検索することも、病態理解や治療法の開発の上で、重要な意味を持つと考えられる。すなわち、アミロイド陽性所見があっても、神経変性のプロセスが始まらないあるいはきわめて緩徐にしか進行しない例が存在することはすでにある程度知られている。このような症例は、おそらくアミロイド抵抗性の因子を持っていると考えられる。このような抵抗因子の検索も治療予防法の開発に結びつく可能性がある。」
このような背景もあって、米国核医学分子イメージング学会(SNMMI)と米国アルツハイマー病協会は2013年1月28日、アルツハイマー病の診断技術として注目されているPET(ポジトロン断層法)アミロイドイメージングに関する初めての適正使用指針を発表し(First guidelines published for brain amyloid imaging in Alzheimer's)、米国アルツハイマー協会発行のAlzheimer's & Dementia誌(http://www.alz.org/news_and_events_60578.asp)、The Journal of Nuclear Medicine誌(http://interactive.snm.org/index.cfm?PageID=12318)に掲載しました。
今回の指針内容を簡単にご紹介しましょう。
PETアミロイドイメージングはアルツハイマー病の診断に有益な手法となると指摘しつつも、PETアミロイドイメージング実施の前に、必ず医師による認知機能の検査を実施することが重要であることを強調しました。
その上で、適切な候補者の条件を3つ示しました。
1 説明の付かない記憶機能の問題がある人。記憶、認知機能の標準的テストで障害が認められる人。
2 テストでアルツハイマー病を疑われる人で、診察では典型的なアルツハイマー病に該当しない人。
3 進行性の認知機能の低下がある65歳未満の人。
また、検査の意義のないケースも2つ示しました。
1 患者が65歳以上で標準的なテストによりアルツハイマー病であると明確であるケース(追加的な価値が乏しいため)。
2 無症状の人で、認知機能の訴えがあるが臨床的には障害を認められない人。
さらに、実施が不適切と考えられる条件として、「認知症の重症度判定、家族歴や危険因子があるだけでの検査、遺伝子検査の代替としての実施、非医学的な理由(保険や法的、雇用)では実施すべきではない」と報告しております。
最初に述べましたように、「Preclinical ADに関しては、現時点では臨床現場での超早期診断を念頭に置いて提唱されているわけではなく、あくまでも臨床治験などの研究で用いることが前提」となっていることをしっかりと肝に銘じて下さいね。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(2013年3月29日公開)
ではいったいアルツハイマー病を発症する何年ほど前に、「Preclinical AD」と診断される可能性があるのでしょうか。
2012年9月10日発行の日経メディカル2012年9月号特別編集版は、2012年7月にカナダのバンクーバーで開催された国際アルツハイマー病会議(AAIC2012)において、以下のような報告があったと伝えています(友吉由紀子:ここまで分かったアルツハイマー病. 日経メディカル2012年9月号特別編集版 6-10 2012)。
「Washington UniversityのRandall Bateman氏は、発症年齢が推定できる家族性AD患者のデータを分析し、発症に至るまでの脳病理の変化を時系列で示した。脳内アミロイドベータ(Aβ)の蓄積がPETで確認できるのは発症15年前からである。脳脊髄液Aβ42は、発症の約25年前、非キャリア群に比べて高値を示していたキャリア群の脳脊髄液Aβ42が減少し始め、発症10年前には非キャリア群よりも有意に低値となっている。今回の結果をそのまま遅発性のADに当てはめることはできないが、Aβ蓄積がPETで検出される時期よりももっと早く、約25年前には脳脊髄液を用いて病気の進行をキャッチできる可能性も出てきたわけだ。」(一部改変)
アセチルコリンは、AD患者の脳内で低下している神経伝達物質の一つです。アセチルコリンエステラーゼとは、アセチルコリンを分解する酵素です。アセチルコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミン)は、アセチルコリンエステラーゼの働きを阻害するため、結果として、脳内のアセチルコリンが分解されにくくなります。それにより脳が活性化していくのです。ADの治療には、このアセチルコリンエステラーゼ阻害薬(AChEI)が主として用いられています。しかし、これは対症療法であり、病気の進行を根本的に食い止める根治療法ではありません。
アセチルコリンの作用については、クリスティーン・ブライデンさんが著書のなかで分かりやすく解説しておりますので以下にご紹介しましょう(一部改変)。
「アセチルコリンは脳内の化学伝達物質で、ニューロンの働きを活性化し、ニューロン間の伝達を促すものだ。基本的に脳の中のアセチルコリンが多いほど、受信状態はよくなる。アルツハイマー病などの認知症ではアセチルコリンが不足しがちになるため、脳の働きが遅くなり、頭の中は『霧の中』にいるような感じになる。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p15)
クリスティーンさんは、1995年に46歳の若さでアルツハイマー病と診断され、1995年10月より当時発売されていたアセチルコリンエステラーゼ阻害薬(AChEI)であるタクリン(1993年に発売開始となった世界初のアルツハイマー病治療薬:肝機能障害の副作用が強く、日本では臨床治験が実施されていません)の服薬を始めました。クリスティーンさんは、その効果について「それから数か月すると、私の頭は霧が晴れたようになり、診断によるトラウマとなんとか向き合う余裕が出てきた」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p113)と述べています。
その後、クリスティーンさんは、1998年に前頭側頭型認知症と再診断されております。
なお、国立病院機構菊池病院の室伏君士名誉院長は、「アルツハイマー病の老化の脳変性過程とは異なる前頭側頭葉変性症へのAChEIの投与については、BPSD(認知症の行動・心理症状)が悪化することも多いと指摘されており留意すべきであろう」(一部改変)と注意を呼びかけています(木村武実:BPSD─症例から学ぶ治療戦略 フジメディカル出版, 大阪, 2012, p3)。
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)【嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013】:
「DIANとはdominantly inherited Alzheimer networkの略であり、大意としては優性遺伝性のアルツハイマー病の両親を持つ子どもたちを対象としたネットワークである。すなわち本研究では彼らに発症前段階からネットワークに登録してもらい、種々のバイオマーカーを計測し、発症までの時間とそれらのバイオマーカーを比較検討したものである。その結果、遺伝性アルツハイマー病患者の発症30年前からのバイオマーカーの変化が明らかとなった。現在はそれらのバイオマーカーの変化が孤発性アルツハイマー病の患者の脳内においても同様に起こっているのではないかと推測されている。
本研究を主導するのはワシントン大学のモリス教授であり、米国国内で7つの施設のほか、英国、オーストラリア、ドイツの施設を加え、合計12の研究機関が参加している。
このネットワークの対象となる患者は、優性遺伝性の家族性アルツハイマー病を起こす遺伝子変異を持つ親の成人した子どもである(エントリー基準では18歳以上)。参加したときに種々の検査を受け、以後3年ごとに検査を継続して受けてもらうこととなっている。今回発表されたのは2009~2011年に研究参加時に行われる最初の検査を終了した128名の結果である。遺伝子変異の内訳は、PSEN1に変異を有する家系が40家系、PSEN2変異が3家系、APP変異は8家系であった。88名がいずれかの遺伝子変異を有するキャリアであり、40名は遺伝子変異を有さない非キャリアであった。キャリアのうちほぼ半数が無症状であった。
髄液検査におけるキャリア群の特徴として、タウのレベルは症状が出現すると予想される15年前から増加し始め、一方、Aβ42の濃度は症状が出現すると予想されるときまで経過とともに低下した。しかしAβ42濃度の推移で注目すべきは、当初はむしろ高値を示し、約20年前の時点で見かけ上正常化し、その後さらに低下していることである。この『高値』はAPI研究でも認められている。
本論文(Bateman RJ, Xiong C, Benzinger TL et al:Clinical and biomarker changes in dominantly inherited Alzheimer's disease. N Engl J Med Vol.367 795-804 2012)の発表後もDIAN研究への登録者は増加し、2012年秋の時点で290人が参加している。そのうち215人は無症候であるという。将来は400例の登録を目標としているという。なお、本論文発表以降、DIAN研究は当初の観察研究から、新たな薬剤介入研究へと進められることが決められた。」(一部改変)
Facebookコメント
「基本的にDIANは観察研究であるが、治験であるDIAN-TTU(またはDIAN-TU)とは連続・融合した活動である。
5.6 DIAN Neuropathology Coreの活動(Dr. Cairns)
DIAN研究に参加されている被験者が亡くなったときの剖検検索を担当する。現在までに、12例の剖検が行われている。12例の中で、アルツハイマー病の病理所見に加え、レビー小体病理を合併する症例が少なくない。興味深いことに、それらの症例において生前、パーキンソン徴候は認められていないことが多い。剖検はADNIと同じプロトコールで行われる。DIAN研究の参加登録者(被験者)のうち85%の方から剖検の生前同意が得られており、病理検索の重要性についても十分認識されていることがうかがえる。」(森 啓、東海林幹夫、池田将樹、池内 健、岩坪 威、嶋田裕之:Dominantly Inherited Alzheimer's Network(DIAN)研究について. Dementia Japan Vol.28 116-126 2014)
Facebookコメント
アミロイドベータ(Aβ)の採血検査が実用化するのでしょうか?
今まで報告されているのは髄液検査の有用性なのですが…・
アルツハイマー、血液一滴で診断 愛知の研究チーム開発(2014年1月22日付朝日新聞・社会面)
http://apital.asahi.com/article/news/2014012200002.html
P.S.
血液バイオマーカー
「ここまで主として、髄液バイオマーカーについて述べてきたが、血液バイオマーカーは髄液よりも非侵襲的で簡便であるという利点がある。しかし、血液中の種々の分子がどの程度直接的にAD脳の病理変化と関連があるのかがほとんどわかっていないために、ADの血液バイオマーカーの探索は主に髄液での有用性が報告されているAβあるいはtau関連バイオマーカーを血液中で検討することから始まっている。しかし、血漿中のバイオマーカーに関しては報告によって結果に矛盾点があり、いまだ確定的なものとはいいがたい。」(徳田隆彦:アルツハイマー病の新診断基準とバイオマーカー. 内科 Vol.109 834-839 2012)
Facebookコメント
2014年1月19日に放送されましたNHKスペシャル「アルツハイマー病をくい止めろ!」(http://www.nhk.or.jp/special/detail/2014/0119/)におきましては、DIAN(ダイアン)研究の詳細も紹介されましたね。
アミロイドβの沈着は、アルツハイマー病発症の25年も前!(http://www.inetmie.or.jp/~kasamie/AD25Y.jpg)であることも分かりやすく紹介されました。
そして番組においては、アルツハイマー病予防として「運動」の重要性が強調されました。非常に興味深い番組でした。
Facebookコメント
「米国オクラホマ州グローブ。湖に面した人口約6600人の町で暮らすブレント・ホイットニーさん(34)は2011年、32歳で家族性アルツハイマー病の遺伝子検査を受けた。検査結果は『陽性』。電話口でそう告げられ、職場の外で泣き崩れた。
病因となる遺伝子を持つ人は、親が認知症になった時期とはぼ同じ年齢で発症するとされている。ブレントさんの祖母が発症後、亡くなったのは55歳。父は48歳で発症、55歳で亡くなった。そこから数えれば、症状が出るまでに自分に残された時間はほぼ15年……。ブレントさんには自分の血をひく13歳の息子と11歳の娘がいる。『残された時間で家族のために何かできるのか、そればかり考えるようになりました』
…(中略)…
ブレントさんの叔父、ダグラス・ホイットニーさん(63)は当時10歳だった。皆、なぜ親戚の多くが若くして脳の病気になるのか分からなかった。この時は、誰かがいなくなってしまう前に全員で写真を撮ろうとした気がする」と振り返る。この後多くの人が発症、再び全員で集まることはなかった。
重い運命も影響して疎遠になりつつあった親族は、家族性アルツハイマー病に焦点をあてたDIAN研究のことを伝え合い、再び連絡を取り始めている。
ブレントさんに研究参加を呼び掛けたのもダグラスさんだ。13年夏には、数十人の親族で集まる予定だという。
こうした家族の協力について、DIAN研究を統括するワシントン大のジョン・モリス教授(65)は『DIANに参加する極めてまれな家族たちが、研究者にとって非常に力強い存在となっている』と強調する。「アルツハイマーは複雑な病気だ。研究を始めて30年間、何度も落胆を味わってきたが、今最もやりがいがある時期を迎えている』と力を込めた。」(読売新聞「認知症」取材班:認知症 明日へのヒント─800万人時代を共に生きる 中央公論新社, 東京, 2014, pp42-46)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第95回『アルツハイマー病の治療薬 アルツハイマー病根本治療薬の姿』(2013年3月30日公開)
アセチルコリンエステラーゼ阻害薬(AChEI)が対症療法であるのに対して、ADに対する疾患修飾性治療(disease modifying therapy;DMT)は、疾患の病態進行の本質的な過程に作用することにより、神経細胞の変性あるいは神経細胞死を遅延させ、結果的に臨床症状の進行を抑える治療法であり、「根本的治療法」となりうるものです。
以前は、「根本治療薬」という表現が用いられることが多かったのですが近年では、「疾患修飾薬」(disease-modifying drug)という用語が用いられるようになってきました。
その理由をファイザー株式会社クリニカルリサーチ統括部神経疾患領域部の藤本陽子部長が以下のように説明しております。
「根本治療薬と対をなす治療薬として症候改善薬がある。現在、ADの治療薬として承認されている薬剤はいずれも症候改善薬である。症候改善薬は、失われた神経機能を補うことにより認知症の臨床症状を改善させる。一方、根本治療薬は疾患の病態進行を遅延させた結果として臨床症状の進行を抑えるものであり、症候改善薬のように薬剤投与後に臨床症状が改善することは通常は期待できない。根本治療薬という語源から、病気を根本的に治す特効薬がイメージされるため過度な期待をもたれてしまいがちだが、実際は服用開始後に効果を実感することすら難しい。したがって最近では、根本治療薬に代わって疾患修飾薬という用語が汎用される傾向にある」(藤本陽子:現在開発されているアルツハイマー病の根本治療薬について教えて下さい. 治療 Vol.93 1910-1912 2011)。
先に述べましたように、期待された多くの根本治療薬(疾患修飾薬)は、臨床試験において実薬群とプラセボ群との間に有意差が認められず治験が不成功に終わっています。根本治療薬の治験が成功しない要因として、「多くの研究者が心の中で思っていることの一つは、根本治療薬の投与時期が遅すぎるのではないか」(荒井啓行:序文─先制医療と認知症予防の展望─. 日本臨牀 Vol.69 Suppl8 1-6 2011)という指摘もされていましたね。
治験の不成功が続くなか、やっと見えてきた一筋の光明について筑波大学医学医療系臨床医学域精神医学の朝田隆教授が報告しております。以下に抜粋してご紹介しましょう(一部改変)。
「米国の製薬メーカーEli Lilly社から、Aβ抗体であるソラネズマブを用い、軽度から中等度AD患者を対象とした2つの二重盲検プラセボ対照第Ⅲ相試験EXPEDITIONの結果が発表された(https://investor.lilly.com/releasedetail.cfm?releaseid=711933)。それによると、認知機能と日常生活機能といういずれの主要評価項目においても効果を認めなかった。
しかし、両方の治験に参加した対象をプールしたデータに基づいてなされた2次解析では、軽度から中等度AD患者全体の認知機能低下について、統計学的に有意な防御効果を認めた。さらに軽度のAD(MMSEで20~26点と定義)患者のサブグループにおける2次解析でも、やはり有意な認知機能への効果(34%の進行抑制)が認められたが、中等度のAD患者では認められなかった。
なおEli Lilly社から、2012年12月にプレスリリースが発表された。その内容は米国、カナダ、欧州規制当局との協議の結果、新たな第Ⅲ相追加試験を実施することを決定したというものである。より早期のADを対象に、ソラネズマブの有効性を確認する治験が世界規模でなされるものと予想される。」(朝田 隆:臨床医学の展望2013─神経病学. 日本医事新報No.4636 80-85 2013)
Facebookコメント
2013年11月8日~10日に松本市において開催されます第32回日本認知症学会学術集会のプログラム・抄録集が2013年10月12日に郵送されてきました。
その中に「ソラネズマブ」に関する演題がありましたので以下にご紹介しましょう(並木千尋、藤越慎治、Eric Siemers et al:抗アミロイドβ抗体Solanezumabの臨床試験結果─日本人被験者での結果─ Dementia Japan Vol.27 518 2013)。
【目的】
solanezumab(SLZ)はアルツハイマー型認知症(AD)の治療薬として開発中のヒト化抗Aβモノクローナル抗体である。軽度から中等度のAD患者を対象に2つの大規模国際共同第3相プラセボ対照二重盲検比較試験EXPEDITION1、2試験を実施し、日本人被験者の副次解析をしたので、その結果を報告する。
【方法】
両試験は、軽度から中等度のAD患者を対象に計16か国で実施した。診断にはNINCDS/ADRDA criteriaを用い、MMSE16~26点の患者を対象とした。被験者はSolanezumab400mg又はプラセボのいずれかに割り付けられ4週間に1回、18カ月の投与を受けた。認知機能症状の評価にはADAS-cog、日常生活機能の評価にはADCS-ADLを用いた。本試験はGCPに基づき患者への倫理面での配慮は十分に行った。
【成績】
両試験には合計2,042例(軽度1,322例)の被験者が無作為に割り付けられ、日本人被験者は181例(軽度126例)であった。両試験において認知機能及び日常生活機能に関する主要評価項目は達成できなかったが、事前に規定した副次解析である両試験の併合解析では、全被験者及び軽度の被験者においてプラセボ群に比べ統計学的に有意な認知機能低下の進行抑制が示された。日本人集団でも全体集団と概ね同様の結果が得られた。安全性は良好であった。
【結論】
EXPEDITION1、2試験における有効性及び安全性データについて日本人部分集団の結果を示し、全体集団の結果と比較する。
P.S.(講演内容より)
EXP1は北南米と日本、EXP2はEUと日本を含めたアジアを主な対象に、国際共同第3相プラセボ対照二重盲検比較試験として、計16カ国で行われました。
副次解析においてMMSEが20~26点と軽度のAD患者では、SLZ群で有意な認知機能の低下抑制効果が認められました(P=0.008)。
なお、今回の試験で主要評価項目を達成できなかったことから、臨床症状に加え、アミロイドPETにより脳内にAβの集積が確認できた軽度AD患者に対象を限定した、新たな国際共同第3相試験が開始されました。
Facebookコメント
「Solanezumab(ソラネズマブ)はAβの中央部分に相当する第13~28番残基にエピトープを有し、Aβオリゴマ一に親和性が高い。2つの大きなphaseⅢ試験(EXPEDITION1/2)では合計2,000名以上の軽度~中等度AD患者を対象としたが、いずれも主要エンドポイントを満たせなかった。しかし、軽度AD群の併合データでの副次解析では偽薬群と比べてわずかながら有意な認知機能低下抑制が示唆され、軽度AD群を対象とした再度のphaseⅢ試験が計画されている。投与群では11C-PiB-PETでのAβ蓄積、MRIでの全脳や海馬の萎縮、CSF中のリン酸化tauなどのバイオマーカーに有意な変化はなかったが、血漿Aβ増加を認めた。有害事象としてARIA(amyloid-related imaging abnormalities)は観察されなかったが、1%程度に狭心症を認めた。」(宮川統爾、岩坪 威、富田泰輔:アルツハイマー病に対する根本治療薬. 医学のあゆみ Vol.247 493-497 2013)
Facebookコメント
アルツハイマー病治療薬候補のsolanezumabとbapineuzumab、いずれも第Ⅲ相試験で臨床的な有効性を示されず【Medical Tribune Vol.47, No.6 3 2014.2.6】
アルツハイマー病(AD)治療薬候補のアミロイドβに対するヒト化モノクローナル抗体薬であるsolanezumabとbapineuzumabの第Ⅲ相試験の結果がそれぞれN Engl J Med(2014年1月23日オンライン版)に同時に掲載された。いずれも軽症~中等症のAD患者を対象とした試験であったが、認知機能などの主要評価項目の有意な改善は認められなかった。
~Solanezumab第Ⅲ相試験~ 認知機能とADL改善せず
有意差ないが、軽症ADへのベネフィットを示唆
Solanezumabの試験結果を報告したのは、米・Baylor College of MedicineのRachelle S. Doody氏ら。同薬の有効性はEXPEDITIONlおよびEXPEDITION2の2件のプラセボ対照ランダム化比較試験で検討された。しかし、主要評価項目である認知機能と日常生活動作(ADL)の改善は達成できなかった。
EXPEDITION2で軽症AD患者に限定して解析した結果も、solanezumab群とプラセボ群におけるADAS-cog14の変化量の差は-1.7点(95%CI:-3.5~0.1点、P=0.06)、中等症AD患者では-1.5点(同:-4.1~1.1点、P=0.26)で、有意ではなかった。安全性については、両試験の統合データを解析した結果、アミロイド関連の異常画像所見発生率は、浮腫がsolanezumab群で0.9%、プラセボ群で0.4%(P=0.27)であった他、出血がsolanezumab群で4.9%、プラセボ群で5.6%(P=0.49)であった。
Facebookコメント
アルツハイマー病(AD)治療薬候補のsolanezumabの第Ⅲ相試験の結果がN Engl J Med(2014年1月23日オンライン版)に掲載されました(http://www.nejm.jp/abstract/vol370.p311)。
ソラネズマブはアルツハイマー病治験薬となるのか、専用の診断薬でのフェーズⅢが開始に
https://bio.nikkeibp.co.jp/article/news/20130718/169662/
米Dow Jones社は2013年7月16日、米Eli Lilly社が開発を進めるアルツハイマー病の治験薬候補のソラネズマブの臨床試験の患者組み入れ基準を変更したと報じた。Eli Lilly社は2012年8月、ソラネズマブの日本を含む国際共同フェーズⅢの結果、主要評価項目を達成できなかったことを公表している。このことから、新たな臨床試験では組み入れの患者を選別して、成功確率を高めることが狙いとみられる。
Facebookコメント
Solanezumab
Solanezumabの治験もphaseⅢの結果プライマリーエンドポイントではプラセボとの間に臨床効果の有意差は見られなかったが、ADAS-cog14を用いた軽症例の二次解析ではMMSEの変化に有意差が見られ、実薬群の経過が有意に良かった。しかし、プラセボ群が80週後にMMSEのスコアが2.8低下したのに対し実薬群では2.1でありその差はわずかである。バイオマーカーでは実薬群で血漿free Aβ40の有意な増加、髄液free Aβ40の有意な減少、total Aβ40,total Aβ42の有意な増加が実薬群で見られた。本抗体は軽症例に限ったことではあるが、Aβを標的とする治療の有効性を示した初めての例であり、アミロイドを標的とする治療の妥当性を支持している。
【田平 武:アルツハイマー病に対する免疫療法の展望. 臨牀と研究 Vol.91 929-934】
Facebookコメント
「Solanezumabは,終了した2つの大規模な治験(EXPEDITION1および2)の結果から軽度AD(MMSEが20~26点)に対象を絞って治験(EXPEDITION3,NCTO1900665,18カ月投与,2,100例)を再開している。」(中村 祐:認知症は完治できるのか?―現在の治療薬の限界. 実験 治療 No.712 56-61 2014)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第228回『親がアルツハイマー病、私の将来はどうかな!─予防的治療薬を与える大規模な研究』(2013年8月15日公開)
アルツハイマー病の原因遺伝子を保有するキャリアに対して、未発症の段階から早期介入または予防的治療薬投与を試みる大規模な研究が進められており、東北大学加齢医学研究所老年医学分野の荒井啓行教授がその概略について言及しております(岩坪 威、荒井啓行、井原康夫:座談会─アルツハイマー病. Current Therapy Vol.30 360-368 2012)。その概要と今後の展望についてご紹介し本稿を閉じたいと思います。
「Alzheimer's Prevention Initiative(API)による臨床研究は、南米のコロンビアにあるアンティオキアという町を舞台にした介入研究の計画です。そこに、あるファウンダー(創始者)から発したと思われるPS-1遺伝子変異の非常に大きな家系があります。その家系の現存者1,235名のうち、480名がミューテーション(変異)をもちながら、まだ発症していないキャリアであり、ミューテーション陽性者の平均発症年齢は48歳であることがわかっています。このキャリアの方を対象に、おそらく20代、30代あたりから、疾患修飾薬による治療を脳脊髄液のAβやアミロイドPETなどのバイオマーカーを用いて追跡しながら行うのです。つまり、アミロイドの蓄積を一度リセットし、アミロイドの全くない脳に戻したときに、はたして発症年齢をどれだけ遅らせることができるかを検討する壮大な研究計画です。」(一部改変)
筑波大学臨床医学系精神医学の朝田隆教授はこの研究について、「Alzheimer's Prevention Initiativeによる臨床研究では、ADを早期に発症する希少な遺伝子変異をもつ大家族で、Genentech社による治療薬crenezumabの効果が試されています。ここでは300名の未発症に人において、従来は避けられなかった認知機能低下に歯止めをかけられるか否か、また発症を遅くすることができるか否かが、5年間の追跡調査により調べられます(Miller G:Alzheimer's research. Stopping Alzheimer's before it starts. Science Vol.337 790-792 2012)。」(朝田 隆:アルツハイマー病の発症予防法の開発. からだの科学通巻278号 161-165 2013)と述べております。
そして、APIの他にも、DIAN(Dominantly Inherited Alzheimer Network)、A4(Anti-Amyloid Treatment in Asymptomatic AD Trial)といった研究組織が有望な検討を模索しております(http://211.144.68.84:9998/91keshi/Public/File/41/337-6096/pdf/790.full.pdf)。
DIANは、既知3タイプのAD原因遺伝子によって生じる早発性ADを研究するために2008年に設立された組織です。
なお、A4の研究対象は、70歳以上でPETによるアミロイドイメージングにて陽性であるが認知機能は正常な人(preclinical AD)であり、Aβを減少させることにより後続する神経細胞死へと至る流れに歯止めをかけられるか否かを検証することを主目的としており、DIANとは異なり、遺伝性ではない弧発性のアルツハイマー病の病理進行に注目して治療介入を目指すものです。
なお、A4研究(http://www.alzforum.org/new/detail.asp?id=3379)におきましては、シリーズ第189回『アルツハイマー病を治す薬への道─アルツハイマー病は3型糖尿病』(http://apital.asahi.com/article/kasama/2013070500006.html)のコメント欄およびシリーズ第95回『アルツハイマー病の治療薬─アルツハイマー病根本治療薬の姿』(http://apital.asahi.com/article/kasama/2013032900005.html)においてご紹介しましたsolanezumab(ソラネズマブ)の効果が試されます。
Facebookコメント
「米国は、『2025年までに効果的な予防と治療法の開発を達成する』と国家的に取り組むことを明確に打ち出した。NIA(National Institute for Aging)が主導して、ADGCとADNIが受け皿となってADSP(Alzheimer's Disease Sequencing Project=https://www.niagads.org/adsp)が進行している。家族性AD100家系以上を対象とした全ゲノムシークエンス並びにAD5,000人とその対照群5,000人の全エクソーム解析が、2013年3月に開始され2015年12月に終了する。これらのプロジェクトは、研究成果を共有して効率的な解析を推進すること基本としている。日本も先導的にこれらの国際共同研究に早く参加しなければ、またしても後手にまわり、単に日本人のデータを提供する隷属研究に陥るであろう。」(桑野良三、月江珠緒:アルツハイマー病診断における遺伝子・バイオマーカーの意義. Dementia Japan Vol.27 334-343 2013)
Facebookコメント
A4研究:
「抗アミロイド抗体による加療により、3年後にバイオマーカーにどのような変化が生じるかを検討するのがA4研究である。すなわち上流にあるアミロイド蓄積を抗体療法によって減らすことにより、下流にある神経細胞死や認知機能低下を予防できないか検討する試験である。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
Facebookコメント
「APIは、南米コロンビアに住む地域住民に多く認められるPSEN1遺伝子にE280A変異を有する早発型家族性アルツハイマー病(early onset familial Alzheimer disease;EOFAD)患者を対象にAβ抗体であるcrenezumabによる抗体療法の効果を検証する試験である。
本家系は25年以上前にコロンビアのアンティオキア大学のLoperaらにより発見されたもので、現在5,000人以上が北コロンビアの山岳地帯に住んでいる。本家系の症状の特徴は早発であるということを除けば、記憶障害で発症することなど、全体的な症状は孤発性のアルツハイマー病とよく似ている。平均発症年齢は47歳である。本家系の多くのキャリアは30代前半で、他に症状がなくても記憶障害を捉えることができるという。本研究では認知機能検査で異常がないと確認された30歳以上のキャリアが試験にリクルートされる。本家系では30歳以上のキャリアなら、既に脳内にはアミロイドの沈着が認められる。
昨年末、本家系の中で未発症である18~26歳の20人においてDIAN研究と同様のバイオマーカーの比較研究を行った結果が発表された(文献20, 21)。その結果、髄液のAβ42はDIAN研究(http://apital.asahi.com/article/kasama/2013032800005.html)と同様に、遺伝子変異を有するキャリアにおいて当初有意な上昇が認められた。頭部MRIでは既に頭頂部および頭頂側頭部の灰白質に萎縮が認められ、fMRIでは海馬の活性化と両側の後部帯状回の非活性化が認められた(文献20)。
また、同時に発表されたアミロイドPET研究では、20~56歳を対象として、遺伝子変異を有するキャリア11人(認知症4人、MCI7人)、未発症キャリア19人、非キャリア20人のアミロイド蓄積量を比較している。その結果、非キャリア群に比べ、未発症キャリア群は有意に蓄積量が多いことが認められた。さらに、3群のデータから、アミロイド蓄積量が発症前から経年的に増加し、プラトーに達した後MCI、認知症へと進行していくことが示された(文献21)。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
参考文献:
20)Reiman EM,Quiroz YT,Fleisher AS et al:Brain imaging and fluid biomarker analysis in young aduls at genetic risk for autosomal dominant Alzheimer's disease in the presenilin 1 E280A kindred: a case-control study. Lancet Neurol Vol.11 1048-1056 2012
21)Fleisher AS,Chen K,Quiroz YT et al:Florbetapir PET analysis of amyloid-beta deposition in the presenilin 1 E280A autosomal dominant Alzheimer's disease kindred: a cross-sectional study. Lancet Neurol Vol.11 1057-1065 2012
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(http://apital.asahi.com/article/kasama/2013032800005.html)のコメント欄において紹介しておりますのでご参照下さい。
Facebookコメント
「遺伝的な要因で発症する『家族性アルツハイマー病』の人たちが国内にどれだけいるか、実態調査を厚生労働省の研究チームが2013年11月から始める。結果をもとにまだ症状のない家族性の人に薬を使って発症を防ぐ試みにつなげたい考えだ。」(http://apital.asahi.com/article/news/2013110700017.html)
これからのアルツハイマー病治験
こうして,臨床的に認知症を発症するより前,脳病変があまり進んでいない段階で治療を開始することが技術的に可能となり,AD病態修飾薬の治験はプレクリニカル期にある未発症AD例を対象とするようになった。Fig.4に示すように,その時期は,バイオマーカー所見の進行度から推測して,おそらく認知機能低下を自覚するMCIよりも前である必要があり,それはおそらく認知症発症の10~30年前であろうと考えられている。このことは治験にいくつかの困難を惹起する。プレクリニカル期AD例を標的とした治験において,単に認知機能正常高齢者を対象とし,エンドポイントを「認知症発症」に置くと,そのままでは,おそらく数千人規模の参加者と5~10年にわたる長期の観察期間を必要とすることになる。そこで現実的な対応として,何らかの方法で対象者をプレクリニカル期AD例に絞り込む,あるいは,少なくとも,プレクリニカル期ADの割合が一般的な認知機能正常高齢者よりもかなり高い集団を事前に用意することが求められる。
現在,Solanezumabを用いて行われている孤発性ADを標的とするA4治験では,PETによるアミロイドイメージングを実施し,陽性者を対象としているが,認知機能正常高齢者におけるアミロイドイメージング陽性者の割合を考慮すると,侵襲・コストの両面で,同様の治験を多数並行して,あるいは繰り返し実施するのは容易なことではない。API(Alzheimer's Prevention Initiative)の優性遺伝性ADの変異キャリア,あるいはApoE4ホモ例を対象とした治験,前述のDIANの延長であるDIAN-TU(trial unit)などでは,慎重な遺伝カウンセリングを含むスキームの構築が求められる。また,治験のエンドポイントを「認知症発症」に置くのではなく,アミロイドイメージングや脳脊髄液バイオマーカーの所見の変化をその代替とすることにより観察期間の短縮を図ることも考えられるが,それが可能かどうかを判断するには,ADNIなどのこれまでに積み重ねてきた厳密な観察研究のさらなる継続が必要である。
【秋山治彦:アルツハイマー病根本治療薬の開発. BRAIN and NERVE vol.68 463-472 2016】
私の感想:
孤発性ADを標的とするA4治験についてはアピタルにおいても記述しました。以下に再掲致します。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第93回『アルツハイマー病の治療薬 期待される根本治療薬』(2013年3月28日公開)
Preclinical ADに関しては、現時点では臨床現場での超早期診断を念頭に置いて提唱されているわけではなく、あくまでも臨床治験などの研究で用いることが前提となっています。
期待された多くの根本治療薬は、臨床試験において実薬群とプラセボ群との間に有意差が認められず治験が不成功に終わっています。根本治療薬の治験が成功しないことの要因として、「多くの研究者が心の中で思っていることの一つは、根本治療薬の投与時期が遅すぎるのではないか」(荒井啓行:序文─先制医療と認知症予防の展望─. 日本臨牀 Vol.69 Suppl8 1-6 2011)という点です。
初期ADであっても、アミロイドの蓄積と広範な神経細胞死が既に生じており、その段階で根本治療薬を投与しても遅いのではないかという考えに立って、「Preclinical AD」という概念が導入されてきたわけです。
東京都健康長寿医療センター研究所附属診療所の石井賢二医師は、Preclinical ADの研究を通して、アルツハイマー病の根本的な克服に向けた発症予防・遅延研究が進んでいくという大きな意義を認めつつも、臨床症状が認められなくとも病気(Preclinical AD)に組み入れることの問題点について言及しております(石井賢二:アミロイドイメージングの現状と有用性. 神経内科 Vol.77 597-605 2012)。
「まず第一に、preclinical ADという言葉が独り歩きすることの倫理的問題である。健常者におけるアミロイド陽性所見が発症のリスクとしての正確な評価が得られていないにもかかわらず、発症が運命づけられているかのように誤解されることは、新しい診断技術が普及する過程で起こりうることである。また、この検査結果が社会的『差別』を生む可能性も指摘されている。保険料が高くなったり、社会的地位から排除されたりする可能性がないとはいえない。リスクとしての評価が定まり、なんらかの発症遅延法が確立されるまでは、みだりに『検診』として用いるべきではないし、結果の開示や取り扱いについても十分な配慮が必要である。
第二点として、この診断基準のストーリーに乗らない症例を見出して検索することも、病態理解や治療法の開発の上で、重要な意味を持つと考えられる。すなわち、アミロイド陽性所見があっても、神経変性のプロセスが始まらないあるいはきわめて緩徐にしか進行しない例が存在することはすでにある程度知られている。このような症例は、おそらくアミロイド抵抗性の因子を持っていると考えられる。このような抵抗因子の検索も治療予防法の開発に結びつく可能性がある。」
このような背景もあって、米国核医学分子イメージング学会(SNMMI)と米国アルツハイマー病協会は2013年1月28日、アルツハイマー病の診断技術として注目されているPET(ポジトロン断層法)アミロイドイメージングに関する初めての適正使用指針を発表し(First guidelines published for brain amyloid imaging in Alzheimer's)、米国アルツハイマー協会発行のAlzheimer's & Dementia誌(http://www.alz.org/news_and_events_60578.asp)、The Journal of Nuclear Medicine誌(http://interactive.snm.org/index.cfm?PageID=12318)に掲載しました。
今回の指針内容を簡単にご紹介しましょう。
PETアミロイドイメージングはアルツハイマー病の診断に有益な手法となると指摘しつつも、PETアミロイドイメージング実施の前に、必ず医師による認知機能の検査を実施することが重要であることを強調しました。
その上で、適切な候補者の条件を3つ示しました。
1 説明の付かない記憶機能の問題がある人。記憶、認知機能の標準的テストで障害が認められる人。
2 テストでアルツハイマー病を疑われる人で、診察では典型的なアルツハイマー病に該当しない人。
3 進行性の認知機能の低下がある65歳未満の人。
また、検査の意義のないケースも2つ示しました。
1 患者が65歳以上で標準的なテストによりアルツハイマー病であると明確であるケース(追加的な価値が乏しいため)。
2 無症状の人で、認知機能の訴えがあるが臨床的には障害を認められない人。
さらに、実施が不適切と考えられる条件として、「認知症の重症度判定、家族歴や危険因子があるだけでの検査、遺伝子検査の代替としての実施、非医学的な理由(保険や法的、雇用)では実施すべきではない」と報告しております。
最初に述べましたように、「Preclinical ADに関しては、現時点では臨床現場での超早期診断を念頭に置いて提唱されているわけではなく、あくまでも臨床治験などの研究で用いることが前提」となっていることをしっかりと肝に銘じて下さいね。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(2013年3月29日公開)
ではいったいアルツハイマー病を発症する何年ほど前に、「Preclinical AD」と診断される可能性があるのでしょうか。
2012年9月10日発行の日経メディカル2012年9月号特別編集版は、2012年7月にカナダのバンクーバーで開催された国際アルツハイマー病会議(AAIC2012)において、以下のような報告があったと伝えています(友吉由紀子:ここまで分かったアルツハイマー病. 日経メディカル2012年9月号特別編集版 6-10 2012)。
「Washington UniversityのRandall Bateman氏は、発症年齢が推定できる家族性AD患者のデータを分析し、発症に至るまでの脳病理の変化を時系列で示した。脳内アミロイドベータ(Aβ)の蓄積がPETで確認できるのは発症15年前からである。脳脊髄液Aβ42は、発症の約25年前、非キャリア群に比べて高値を示していたキャリア群の脳脊髄液Aβ42が減少し始め、発症10年前には非キャリア群よりも有意に低値となっている。今回の結果をそのまま遅発性のADに当てはめることはできないが、Aβ蓄積がPETで検出される時期よりももっと早く、約25年前には脳脊髄液を用いて病気の進行をキャッチできる可能性も出てきたわけだ。」(一部改変)
アセチルコリンは、AD患者の脳内で低下している神経伝達物質の一つです。アセチルコリンエステラーゼとは、アセチルコリンを分解する酵素です。アセチルコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミン)は、アセチルコリンエステラーゼの働きを阻害するため、結果として、脳内のアセチルコリンが分解されにくくなります。それにより脳が活性化していくのです。ADの治療には、このアセチルコリンエステラーゼ阻害薬(AChEI)が主として用いられています。しかし、これは対症療法であり、病気の進行を根本的に食い止める根治療法ではありません。
アセチルコリンの作用については、クリスティーン・ブライデンさんが著書のなかで分かりやすく解説しておりますので以下にご紹介しましょう(一部改変)。
「アセチルコリンは脳内の化学伝達物質で、ニューロンの働きを活性化し、ニューロン間の伝達を促すものだ。基本的に脳の中のアセチルコリンが多いほど、受信状態はよくなる。アルツハイマー病などの認知症ではアセチルコリンが不足しがちになるため、脳の働きが遅くなり、頭の中は『霧の中』にいるような感じになる。」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p15)
クリスティーンさんは、1995年に46歳の若さでアルツハイマー病と診断され、1995年10月より当時発売されていたアセチルコリンエステラーゼ阻害薬(AChEI)であるタクリン(1993年に発売開始となった世界初のアルツハイマー病治療薬:肝機能障害の副作用が強く、日本では臨床治験が実施されていません)の服薬を始めました。クリスティーンさんは、その効果について「それから数か月すると、私の頭は霧が晴れたようになり、診断によるトラウマとなんとか向き合う余裕が出てきた」(クリスティーン・ブライデン:私は私になっていく─痴呆とダンスを 馬籠久美子・桧垣陽子訳, クリエイツかもがわ, 2004, p113)と述べています。
その後、クリスティーンさんは、1998年に前頭側頭型認知症と再診断されております。
なお、国立病院機構菊池病院の室伏君士名誉院長は、「アルツハイマー病の老化の脳変性過程とは異なる前頭側頭葉変性症へのAChEIの投与については、BPSD(認知症の行動・心理症状)が悪化することも多いと指摘されており留意すべきであろう」(一部改変)と注意を呼びかけています(木村武実:BPSD─症例から学ぶ治療戦略 フジメディカル出版, 大阪, 2012, p3)。
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)【嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013】:
「DIANとはdominantly inherited Alzheimer networkの略であり、大意としては優性遺伝性のアルツハイマー病の両親を持つ子どもたちを対象としたネットワークである。すなわち本研究では彼らに発症前段階からネットワークに登録してもらい、種々のバイオマーカーを計測し、発症までの時間とそれらのバイオマーカーを比較検討したものである。その結果、遺伝性アルツハイマー病患者の発症30年前からのバイオマーカーの変化が明らかとなった。現在はそれらのバイオマーカーの変化が孤発性アルツハイマー病の患者の脳内においても同様に起こっているのではないかと推測されている。
本研究を主導するのはワシントン大学のモリス教授であり、米国国内で7つの施設のほか、英国、オーストラリア、ドイツの施設を加え、合計12の研究機関が参加している。
このネットワークの対象となる患者は、優性遺伝性の家族性アルツハイマー病を起こす遺伝子変異を持つ親の成人した子どもである(エントリー基準では18歳以上)。参加したときに種々の検査を受け、以後3年ごとに検査を継続して受けてもらうこととなっている。今回発表されたのは2009~2011年に研究参加時に行われる最初の検査を終了した128名の結果である。遺伝子変異の内訳は、PSEN1に変異を有する家系が40家系、PSEN2変異が3家系、APP変異は8家系であった。88名がいずれかの遺伝子変異を有するキャリアであり、40名は遺伝子変異を有さない非キャリアであった。キャリアのうちほぼ半数が無症状であった。
髄液検査におけるキャリア群の特徴として、タウのレベルは症状が出現すると予想される15年前から増加し始め、一方、Aβ42の濃度は症状が出現すると予想されるときまで経過とともに低下した。しかしAβ42濃度の推移で注目すべきは、当初はむしろ高値を示し、約20年前の時点で見かけ上正常化し、その後さらに低下していることである。この『高値』はAPI研究でも認められている。
本論文(Bateman RJ, Xiong C, Benzinger TL et al:Clinical and biomarker changes in dominantly inherited Alzheimer's disease. N Engl J Med Vol.367 795-804 2012)の発表後もDIAN研究への登録者は増加し、2012年秋の時点で290人が参加している。そのうち215人は無症候であるという。将来は400例の登録を目標としているという。なお、本論文発表以降、DIAN研究は当初の観察研究から、新たな薬剤介入研究へと進められることが決められた。」(一部改変)
Facebookコメント
「基本的にDIANは観察研究であるが、治験であるDIAN-TTU(またはDIAN-TU)とは連続・融合した活動である。
5.6 DIAN Neuropathology Coreの活動(Dr. Cairns)
DIAN研究に参加されている被験者が亡くなったときの剖検検索を担当する。現在までに、12例の剖検が行われている。12例の中で、アルツハイマー病の病理所見に加え、レビー小体病理を合併する症例が少なくない。興味深いことに、それらの症例において生前、パーキンソン徴候は認められていないことが多い。剖検はADNIと同じプロトコールで行われる。DIAN研究の参加登録者(被験者)のうち85%の方から剖検の生前同意が得られており、病理検索の重要性についても十分認識されていることがうかがえる。」(森 啓、東海林幹夫、池田将樹、池内 健、岩坪 威、嶋田裕之:Dominantly Inherited Alzheimer's Network(DIAN)研究について. Dementia Japan Vol.28 116-126 2014)
Facebookコメント
アミロイドベータ(Aβ)の採血検査が実用化するのでしょうか?
今まで報告されているのは髄液検査の有用性なのですが…・
アルツハイマー、血液一滴で診断 愛知の研究チーム開発(2014年1月22日付朝日新聞・社会面)
http://apital.asahi.com/article/news/2014012200002.html
P.S.
血液バイオマーカー
「ここまで主として、髄液バイオマーカーについて述べてきたが、血液バイオマーカーは髄液よりも非侵襲的で簡便であるという利点がある。しかし、血液中の種々の分子がどの程度直接的にAD脳の病理変化と関連があるのかがほとんどわかっていないために、ADの血液バイオマーカーの探索は主に髄液での有用性が報告されているAβあるいはtau関連バイオマーカーを血液中で検討することから始まっている。しかし、血漿中のバイオマーカーに関しては報告によって結果に矛盾点があり、いまだ確定的なものとはいいがたい。」(徳田隆彦:アルツハイマー病の新診断基準とバイオマーカー. 内科 Vol.109 834-839 2012)
Facebookコメント
2014年1月19日に放送されましたNHKスペシャル「アルツハイマー病をくい止めろ!」(http://www.nhk.or.jp/special/detail/2014/0119/)におきましては、DIAN(ダイアン)研究の詳細も紹介されましたね。
アミロイドβの沈着は、アルツハイマー病発症の25年も前!(http://www.inetmie.or.jp/~kasamie/AD25Y.jpg)であることも分かりやすく紹介されました。
そして番組においては、アルツハイマー病予防として「運動」の重要性が強調されました。非常に興味深い番組でした。
Facebookコメント
「米国オクラホマ州グローブ。湖に面した人口約6600人の町で暮らすブレント・ホイットニーさん(34)は2011年、32歳で家族性アルツハイマー病の遺伝子検査を受けた。検査結果は『陽性』。電話口でそう告げられ、職場の外で泣き崩れた。
病因となる遺伝子を持つ人は、親が認知症になった時期とはぼ同じ年齢で発症するとされている。ブレントさんの祖母が発症後、亡くなったのは55歳。父は48歳で発症、55歳で亡くなった。そこから数えれば、症状が出るまでに自分に残された時間はほぼ15年……。ブレントさんには自分の血をひく13歳の息子と11歳の娘がいる。『残された時間で家族のために何かできるのか、そればかり考えるようになりました』
…(中略)…
ブレントさんの叔父、ダグラス・ホイットニーさん(63)は当時10歳だった。皆、なぜ親戚の多くが若くして脳の病気になるのか分からなかった。この時は、誰かがいなくなってしまう前に全員で写真を撮ろうとした気がする」と振り返る。この後多くの人が発症、再び全員で集まることはなかった。
重い運命も影響して疎遠になりつつあった親族は、家族性アルツハイマー病に焦点をあてたDIAN研究のことを伝え合い、再び連絡を取り始めている。
ブレントさんに研究参加を呼び掛けたのもダグラスさんだ。13年夏には、数十人の親族で集まる予定だという。
こうした家族の協力について、DIAN研究を統括するワシントン大のジョン・モリス教授(65)は『DIANに参加する極めてまれな家族たちが、研究者にとって非常に力強い存在となっている』と強調する。「アルツハイマーは複雑な病気だ。研究を始めて30年間、何度も落胆を味わってきたが、今最もやりがいがある時期を迎えている』と力を込めた。」(読売新聞「認知症」取材班:認知症 明日へのヒント─800万人時代を共に生きる 中央公論新社, 東京, 2014, pp42-46)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第95回『アルツハイマー病の治療薬 アルツハイマー病根本治療薬の姿』(2013年3月30日公開)
アセチルコリンエステラーゼ阻害薬(AChEI)が対症療法であるのに対して、ADに対する疾患修飾性治療(disease modifying therapy;DMT)は、疾患の病態進行の本質的な過程に作用することにより、神経細胞の変性あるいは神経細胞死を遅延させ、結果的に臨床症状の進行を抑える治療法であり、「根本的治療法」となりうるものです。
以前は、「根本治療薬」という表現が用いられることが多かったのですが近年では、「疾患修飾薬」(disease-modifying drug)という用語が用いられるようになってきました。
その理由をファイザー株式会社クリニカルリサーチ統括部神経疾患領域部の藤本陽子部長が以下のように説明しております。
「根本治療薬と対をなす治療薬として症候改善薬がある。現在、ADの治療薬として承認されている薬剤はいずれも症候改善薬である。症候改善薬は、失われた神経機能を補うことにより認知症の臨床症状を改善させる。一方、根本治療薬は疾患の病態進行を遅延させた結果として臨床症状の進行を抑えるものであり、症候改善薬のように薬剤投与後に臨床症状が改善することは通常は期待できない。根本治療薬という語源から、病気を根本的に治す特効薬がイメージされるため過度な期待をもたれてしまいがちだが、実際は服用開始後に効果を実感することすら難しい。したがって最近では、根本治療薬に代わって疾患修飾薬という用語が汎用される傾向にある」(藤本陽子:現在開発されているアルツハイマー病の根本治療薬について教えて下さい. 治療 Vol.93 1910-1912 2011)。
先に述べましたように、期待された多くの根本治療薬(疾患修飾薬)は、臨床試験において実薬群とプラセボ群との間に有意差が認められず治験が不成功に終わっています。根本治療薬の治験が成功しない要因として、「多くの研究者が心の中で思っていることの一つは、根本治療薬の投与時期が遅すぎるのではないか」(荒井啓行:序文─先制医療と認知症予防の展望─. 日本臨牀 Vol.69 Suppl8 1-6 2011)という指摘もされていましたね。
治験の不成功が続くなか、やっと見えてきた一筋の光明について筑波大学医学医療系臨床医学域精神医学の朝田隆教授が報告しております。以下に抜粋してご紹介しましょう(一部改変)。
「米国の製薬メーカーEli Lilly社から、Aβ抗体であるソラネズマブを用い、軽度から中等度AD患者を対象とした2つの二重盲検プラセボ対照第Ⅲ相試験EXPEDITIONの結果が発表された(https://investor.lilly.com/releasedetail.cfm?releaseid=711933)。それによると、認知機能と日常生活機能といういずれの主要評価項目においても効果を認めなかった。
しかし、両方の治験に参加した対象をプールしたデータに基づいてなされた2次解析では、軽度から中等度AD患者全体の認知機能低下について、統計学的に有意な防御効果を認めた。さらに軽度のAD(MMSEで20~26点と定義)患者のサブグループにおける2次解析でも、やはり有意な認知機能への効果(34%の進行抑制)が認められたが、中等度のAD患者では認められなかった。
なおEli Lilly社から、2012年12月にプレスリリースが発表された。その内容は米国、カナダ、欧州規制当局との協議の結果、新たな第Ⅲ相追加試験を実施することを決定したというものである。より早期のADを対象に、ソラネズマブの有効性を確認する治験が世界規模でなされるものと予想される。」(朝田 隆:臨床医学の展望2013─神経病学. 日本医事新報No.4636 80-85 2013)
Facebookコメント
2013年11月8日~10日に松本市において開催されます第32回日本認知症学会学術集会のプログラム・抄録集が2013年10月12日に郵送されてきました。
その中に「ソラネズマブ」に関する演題がありましたので以下にご紹介しましょう(並木千尋、藤越慎治、Eric Siemers et al:抗アミロイドβ抗体Solanezumabの臨床試験結果─日本人被験者での結果─ Dementia Japan Vol.27 518 2013)。
【目的】
solanezumab(SLZ)はアルツハイマー型認知症(AD)の治療薬として開発中のヒト化抗Aβモノクローナル抗体である。軽度から中等度のAD患者を対象に2つの大規模国際共同第3相プラセボ対照二重盲検比較試験EXPEDITION1、2試験を実施し、日本人被験者の副次解析をしたので、その結果を報告する。
【方法】
両試験は、軽度から中等度のAD患者を対象に計16か国で実施した。診断にはNINCDS/ADRDA criteriaを用い、MMSE16~26点の患者を対象とした。被験者はSolanezumab400mg又はプラセボのいずれかに割り付けられ4週間に1回、18カ月の投与を受けた。認知機能症状の評価にはADAS-cog、日常生活機能の評価にはADCS-ADLを用いた。本試験はGCPに基づき患者への倫理面での配慮は十分に行った。
【成績】
両試験には合計2,042例(軽度1,322例)の被験者が無作為に割り付けられ、日本人被験者は181例(軽度126例)であった。両試験において認知機能及び日常生活機能に関する主要評価項目は達成できなかったが、事前に規定した副次解析である両試験の併合解析では、全被験者及び軽度の被験者においてプラセボ群に比べ統計学的に有意な認知機能低下の進行抑制が示された。日本人集団でも全体集団と概ね同様の結果が得られた。安全性は良好であった。
【結論】
EXPEDITION1、2試験における有効性及び安全性データについて日本人部分集団の結果を示し、全体集団の結果と比較する。
P.S.(講演内容より)
EXP1は北南米と日本、EXP2はEUと日本を含めたアジアを主な対象に、国際共同第3相プラセボ対照二重盲検比較試験として、計16カ国で行われました。
副次解析においてMMSEが20~26点と軽度のAD患者では、SLZ群で有意な認知機能の低下抑制効果が認められました(P=0.008)。
なお、今回の試験で主要評価項目を達成できなかったことから、臨床症状に加え、アミロイドPETにより脳内にAβの集積が確認できた軽度AD患者に対象を限定した、新たな国際共同第3相試験が開始されました。
Facebookコメント
「Solanezumab(ソラネズマブ)はAβの中央部分に相当する第13~28番残基にエピトープを有し、Aβオリゴマ一に親和性が高い。2つの大きなphaseⅢ試験(EXPEDITION1/2)では合計2,000名以上の軽度~中等度AD患者を対象としたが、いずれも主要エンドポイントを満たせなかった。しかし、軽度AD群の併合データでの副次解析では偽薬群と比べてわずかながら有意な認知機能低下抑制が示唆され、軽度AD群を対象とした再度のphaseⅢ試験が計画されている。投与群では11C-PiB-PETでのAβ蓄積、MRIでの全脳や海馬の萎縮、CSF中のリン酸化tauなどのバイオマーカーに有意な変化はなかったが、血漿Aβ増加を認めた。有害事象としてARIA(amyloid-related imaging abnormalities)は観察されなかったが、1%程度に狭心症を認めた。」(宮川統爾、岩坪 威、富田泰輔:アルツハイマー病に対する根本治療薬. 医学のあゆみ Vol.247 493-497 2013)
Facebookコメント
アルツハイマー病治療薬候補のsolanezumabとbapineuzumab、いずれも第Ⅲ相試験で臨床的な有効性を示されず【Medical Tribune Vol.47, No.6 3 2014.2.6】
アルツハイマー病(AD)治療薬候補のアミロイドβに対するヒト化モノクローナル抗体薬であるsolanezumabとbapineuzumabの第Ⅲ相試験の結果がそれぞれN Engl J Med(2014年1月23日オンライン版)に同時に掲載された。いずれも軽症~中等症のAD患者を対象とした試験であったが、認知機能などの主要評価項目の有意な改善は認められなかった。
~Solanezumab第Ⅲ相試験~ 認知機能とADL改善せず
有意差ないが、軽症ADへのベネフィットを示唆
Solanezumabの試験結果を報告したのは、米・Baylor College of MedicineのRachelle S. Doody氏ら。同薬の有効性はEXPEDITIONlおよびEXPEDITION2の2件のプラセボ対照ランダム化比較試験で検討された。しかし、主要評価項目である認知機能と日常生活動作(ADL)の改善は達成できなかった。
EXPEDITION2で軽症AD患者に限定して解析した結果も、solanezumab群とプラセボ群におけるADAS-cog14の変化量の差は-1.7点(95%CI:-3.5~0.1点、P=0.06)、中等症AD患者では-1.5点(同:-4.1~1.1点、P=0.26)で、有意ではなかった。安全性については、両試験の統合データを解析した結果、アミロイド関連の異常画像所見発生率は、浮腫がsolanezumab群で0.9%、プラセボ群で0.4%(P=0.27)であった他、出血がsolanezumab群で4.9%、プラセボ群で5.6%(P=0.49)であった。
Facebookコメント
アルツハイマー病(AD)治療薬候補のsolanezumabの第Ⅲ相試験の結果がN Engl J Med(2014年1月23日オンライン版)に掲載されました(http://www.nejm.jp/abstract/vol370.p311)。
ソラネズマブはアルツハイマー病治験薬となるのか、専用の診断薬でのフェーズⅢが開始に
https://bio.nikkeibp.co.jp/article/news/20130718/169662/
米Dow Jones社は2013年7月16日、米Eli Lilly社が開発を進めるアルツハイマー病の治験薬候補のソラネズマブの臨床試験の患者組み入れ基準を変更したと報じた。Eli Lilly社は2012年8月、ソラネズマブの日本を含む国際共同フェーズⅢの結果、主要評価項目を達成できなかったことを公表している。このことから、新たな臨床試験では組み入れの患者を選別して、成功確率を高めることが狙いとみられる。
Facebookコメント
Solanezumab
Solanezumabの治験もphaseⅢの結果プライマリーエンドポイントではプラセボとの間に臨床効果の有意差は見られなかったが、ADAS-cog14を用いた軽症例の二次解析ではMMSEの変化に有意差が見られ、実薬群の経過が有意に良かった。しかし、プラセボ群が80週後にMMSEのスコアが2.8低下したのに対し実薬群では2.1でありその差はわずかである。バイオマーカーでは実薬群で血漿free Aβ40の有意な増加、髄液free Aβ40の有意な減少、total Aβ40,total Aβ42の有意な増加が実薬群で見られた。本抗体は軽症例に限ったことではあるが、Aβを標的とする治療の有効性を示した初めての例であり、アミロイドを標的とする治療の妥当性を支持している。
【田平 武:アルツハイマー病に対する免疫療法の展望. 臨牀と研究 Vol.91 929-934】
Facebookコメント
「Solanezumabは,終了した2つの大規模な治験(EXPEDITION1および2)の結果から軽度AD(MMSEが20~26点)に対象を絞って治験(EXPEDITION3,NCTO1900665,18カ月投与,2,100例)を再開している。」(中村 祐:認知症は完治できるのか?―現在の治療薬の限界. 実験 治療 No.712 56-61 2014)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第228回『親がアルツハイマー病、私の将来はどうかな!─予防的治療薬を与える大規模な研究』(2013年8月15日公開)
アルツハイマー病の原因遺伝子を保有するキャリアに対して、未発症の段階から早期介入または予防的治療薬投与を試みる大規模な研究が進められており、東北大学加齢医学研究所老年医学分野の荒井啓行教授がその概略について言及しております(岩坪 威、荒井啓行、井原康夫:座談会─アルツハイマー病. Current Therapy Vol.30 360-368 2012)。その概要と今後の展望についてご紹介し本稿を閉じたいと思います。
「Alzheimer's Prevention Initiative(API)による臨床研究は、南米のコロンビアにあるアンティオキアという町を舞台にした介入研究の計画です。そこに、あるファウンダー(創始者)から発したと思われるPS-1遺伝子変異の非常に大きな家系があります。その家系の現存者1,235名のうち、480名がミューテーション(変異)をもちながら、まだ発症していないキャリアであり、ミューテーション陽性者の平均発症年齢は48歳であることがわかっています。このキャリアの方を対象に、おそらく20代、30代あたりから、疾患修飾薬による治療を脳脊髄液のAβやアミロイドPETなどのバイオマーカーを用いて追跡しながら行うのです。つまり、アミロイドの蓄積を一度リセットし、アミロイドの全くない脳に戻したときに、はたして発症年齢をどれだけ遅らせることができるかを検討する壮大な研究計画です。」(一部改変)
筑波大学臨床医学系精神医学の朝田隆教授はこの研究について、「Alzheimer's Prevention Initiativeによる臨床研究では、ADを早期に発症する希少な遺伝子変異をもつ大家族で、Genentech社による治療薬crenezumabの効果が試されています。ここでは300名の未発症に人において、従来は避けられなかった認知機能低下に歯止めをかけられるか否か、また発症を遅くすることができるか否かが、5年間の追跡調査により調べられます(Miller G:Alzheimer's research. Stopping Alzheimer's before it starts. Science Vol.337 790-792 2012)。」(朝田 隆:アルツハイマー病の発症予防法の開発. からだの科学通巻278号 161-165 2013)と述べております。
そして、APIの他にも、DIAN(Dominantly Inherited Alzheimer Network)、A4(Anti-Amyloid Treatment in Asymptomatic AD Trial)といった研究組織が有望な検討を模索しております(http://211.144.68.84:9998/91keshi/Public/File/41/337-6096/pdf/790.full.pdf)。
DIANは、既知3タイプのAD原因遺伝子によって生じる早発性ADを研究するために2008年に設立された組織です。
なお、A4の研究対象は、70歳以上でPETによるアミロイドイメージングにて陽性であるが認知機能は正常な人(preclinical AD)であり、Aβを減少させることにより後続する神経細胞死へと至る流れに歯止めをかけられるか否かを検証することを主目的としており、DIANとは異なり、遺伝性ではない弧発性のアルツハイマー病の病理進行に注目して治療介入を目指すものです。
なお、A4研究(http://www.alzforum.org/new/detail.asp?id=3379)におきましては、シリーズ第189回『アルツハイマー病を治す薬への道─アルツハイマー病は3型糖尿病』(http://apital.asahi.com/article/kasama/2013070500006.html)のコメント欄およびシリーズ第95回『アルツハイマー病の治療薬─アルツハイマー病根本治療薬の姿』(http://apital.asahi.com/article/kasama/2013032900005.html)においてご紹介しましたsolanezumab(ソラネズマブ)の効果が試されます。
Facebookコメント
「米国は、『2025年までに効果的な予防と治療法の開発を達成する』と国家的に取り組むことを明確に打ち出した。NIA(National Institute for Aging)が主導して、ADGCとADNIが受け皿となってADSP(Alzheimer's Disease Sequencing Project=https://www.niagads.org/adsp)が進行している。家族性AD100家系以上を対象とした全ゲノムシークエンス並びにAD5,000人とその対照群5,000人の全エクソーム解析が、2013年3月に開始され2015年12月に終了する。これらのプロジェクトは、研究成果を共有して効率的な解析を推進すること基本としている。日本も先導的にこれらの国際共同研究に早く参加しなければ、またしても後手にまわり、単に日本人のデータを提供する隷属研究に陥るであろう。」(桑野良三、月江珠緒:アルツハイマー病診断における遺伝子・バイオマーカーの意義. Dementia Japan Vol.27 334-343 2013)
Facebookコメント
A4研究:
「抗アミロイド抗体による加療により、3年後にバイオマーカーにどのような変化が生じるかを検討するのがA4研究である。すなわち上流にあるアミロイド蓄積を抗体療法によって減らすことにより、下流にある神経細胞死や認知機能低下を予防できないか検討する試験である。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
Facebookコメント
「APIは、南米コロンビアに住む地域住民に多く認められるPSEN1遺伝子にE280A変異を有する早発型家族性アルツハイマー病(early onset familial Alzheimer disease;EOFAD)患者を対象にAβ抗体であるcrenezumabによる抗体療法の効果を検証する試験である。
本家系は25年以上前にコロンビアのアンティオキア大学のLoperaらにより発見されたもので、現在5,000人以上が北コロンビアの山岳地帯に住んでいる。本家系の症状の特徴は早発であるということを除けば、記憶障害で発症することなど、全体的な症状は孤発性のアルツハイマー病とよく似ている。平均発症年齢は47歳である。本家系の多くのキャリアは30代前半で、他に症状がなくても記憶障害を捉えることができるという。本研究では認知機能検査で異常がないと確認された30歳以上のキャリアが試験にリクルートされる。本家系では30歳以上のキャリアなら、既に脳内にはアミロイドの沈着が認められる。
昨年末、本家系の中で未発症である18~26歳の20人においてDIAN研究と同様のバイオマーカーの比較研究を行った結果が発表された(文献20, 21)。その結果、髄液のAβ42はDIAN研究(http://apital.asahi.com/article/kasama/2013032800005.html)と同様に、遺伝子変異を有するキャリアにおいて当初有意な上昇が認められた。頭部MRIでは既に頭頂部および頭頂側頭部の灰白質に萎縮が認められ、fMRIでは海馬の活性化と両側の後部帯状回の非活性化が認められた(文献20)。
また、同時に発表されたアミロイドPET研究では、20~56歳を対象として、遺伝子変異を有するキャリア11人(認知症4人、MCI7人)、未発症キャリア19人、非キャリア20人のアミロイド蓄積量を比較している。その結果、非キャリア群に比べ、未発症キャリア群は有意に蓄積量が多いことが認められた。さらに、3群のデータから、アミロイド蓄積量が発症前から経年的に増加し、プラトーに達した後MCI、認知症へと進行していくことが示された(文献21)。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
参考文献:
20)Reiman EM,Quiroz YT,Fleisher AS et al:Brain imaging and fluid biomarker analysis in young aduls at genetic risk for autosomal dominant Alzheimer's disease in the presenilin 1 E280A kindred: a case-control study. Lancet Neurol Vol.11 1048-1056 2012
21)Fleisher AS,Chen K,Quiroz YT et al:Florbetapir PET analysis of amyloid-beta deposition in the presenilin 1 E280A autosomal dominant Alzheimer's disease kindred: a cross-sectional study. Lancet Neurol Vol.11 1057-1065 2012
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(http://apital.asahi.com/article/kasama/2013032800005.html)のコメント欄において紹介しておりますのでご参照下さい。
Facebookコメント
「遺伝的な要因で発症する『家族性アルツハイマー病』の人たちが国内にどれだけいるか、実態調査を厚生労働省の研究チームが2013年11月から始める。結果をもとにまだ症状のない家族性の人に薬を使って発症を防ぐ試みにつなげたい考えだ。」(http://apital.asahi.com/article/news/2013110700017.html)
ケンブリッジ市の一般開業医に質問紙法で実施した認知症および末期がん患者への告知状況に関する調査 [認知症の告知]
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第276回『難しい早期診断と告知─家族には辛い思いをさせたくない』(2013年10月4日公開)
ご本人に対しては辛い告知は控えたいと家族が望む姿勢は、終末期の延命治療において、「自分自身だったら認知症の末期に延命措置は希望しない。しかし、家族には一日でも長く生きていて欲しい」と望む日本人の家族観とどこか共通する部分がありますね。この部分は、日本人の「優しさ」なのだと私は解釈しております。
辛い告知は控えたいという考えは、かつての早期癌、末期癌告知における告知率の顕著な違いと似かよった問題でもありますね。
私はかつて、「欧米特にアメリカでは、進行癌であれ、また小児であれ、ほぼ100%の告知率である。しかし日本では、がん告知賛成医師は早期癌で67%(がん告知希望患者86%)、進行がんで16%(同71%)という現状である」という当時の現状を論文において指摘し、カルテ開示にとって支障となる諸問題点について言及したことがあります(笠間 睦:外来カルテ開示に対する反響. 1999年4月17日発行日本医事新報No.3912 時論 73-77 1999)。当時はがんの告知問題が大きな課題でした。しかし、現在は、アルツハイマー病の告知が大きな問題になっています。
アルツハイマー病の告知に関しては、海外の報告においても賛否両論で意見が分かれている現状が報告されています。
「ケンブリッジ市の一般開業医に質問紙法で実施した認知症および末期がん患者への告知状況に関する調査では、末期がん患者に対し『必ず』告知しているが27.0%、『しばしば』告知しているが67.6%に対して、認知症患者には『必ず』告知しているが5.0%、『しばしば』告知しているが34.2%であった(Vassilas CA, Donaldson J:Telling the truth;what do general practitioners say to patients with dementia or terminal cancer? British Journal of General practice Vol.48 1081-1082 1998)。このように、認知症患者への告知は、がん患者への告知と比較して開業医が躊跨している現状が分かる。」(今井幸充:認知症の病名告知とインフォームド・コンセント. 日本認知症ケア学会誌 Vol.10 421-428 2012)
ご本人に対しては辛い告知は控えたいと家族が望む姿勢は、終末期の延命治療において、「自分自身だったら認知症の末期に延命措置は希望しない。しかし、家族には一日でも長く生きていて欲しい」と望む日本人の家族観とどこか共通する部分がありますね。この部分は、日本人の「優しさ」なのだと私は解釈しております。
辛い告知は控えたいという考えは、かつての早期癌、末期癌告知における告知率の顕著な違いと似かよった問題でもありますね。
私はかつて、「欧米特にアメリカでは、進行癌であれ、また小児であれ、ほぼ100%の告知率である。しかし日本では、がん告知賛成医師は早期癌で67%(がん告知希望患者86%)、進行がんで16%(同71%)という現状である」という当時の現状を論文において指摘し、カルテ開示にとって支障となる諸問題点について言及したことがあります(笠間 睦:外来カルテ開示に対する反響. 1999年4月17日発行日本医事新報No.3912 時論 73-77 1999)。当時はがんの告知問題が大きな課題でした。しかし、現在は、アルツハイマー病の告知が大きな問題になっています。
アルツハイマー病の告知に関しては、海外の報告においても賛否両論で意見が分かれている現状が報告されています。
「ケンブリッジ市の一般開業医に質問紙法で実施した認知症および末期がん患者への告知状況に関する調査では、末期がん患者に対し『必ず』告知しているが27.0%、『しばしば』告知しているが67.6%に対して、認知症患者には『必ず』告知しているが5.0%、『しばしば』告知しているが34.2%であった(Vassilas CA, Donaldson J:Telling the truth;what do general practitioners say to patients with dementia or terminal cancer? British Journal of General practice Vol.48 1081-1082 1998)。このように、認知症患者への告知は、がん患者への告知と比較して開業医が躊跨している現状が分かる。」(今井幸充:認知症の病名告知とインフォームド・コンセント. 日本認知症ケア学会誌 Vol.10 421-428 2012)
認知症の遺伝子検査 [アルツハイマー病]
認知症の遺伝子検査
若年認知症の方より時折、「遺伝子検査」を受けた方が良いかどうかを質問されることがあります。
アピタルでそれに関して言及しておりますので以下にご紹介致します。
結論から言いますと、「家族性と判明しても治療法がない」(朝日新聞アピタル「ひょっとして認知症-PartⅡ」第225回)ということになります。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第222回『親がアルツハイマー病、私の将来はどうかな!─90歳まで生きたら2人に1人』(2013年8月9日公開)
メールで送信されてくる質問に、以下のような相談内容が時折あります。
「母が70代でアルツハイマー病を発症しました。自分もなるのでは…と心配です。物忘れが少しあります。早めに検査を受ける方が良いのでしょうか?」(40代女性)
早めに検査する方がよいのかどうかについてお話する前に、まずは認知症の有病率について考えてみましょう。
筑波大学附属病院・副病院長で筑波大学大学院人間総合科学研究科病態制御医学専攻神経病態医学分野(臨床医学系神経内科)の玉岡晃教授は、「本邦における65歳以上の高齢者における認知症の有病率は3.8~11.0%と報告されている」(玉岡 晃:認知症疾患ガイドライン─最新の現状─ Geriat Med Vol.49 749-754 2011)と述べています。
この報告にもありますように、ごく最近まで「認知症の有病率(65歳以上)は、4~8%」(認知症テキストブック 中外医学社, 東京, 2008, pp12-13)と考えられてきました。
しかし、2013年6月1日付朝日新聞1面トップニュースにおいて、最新の認知症高齢者推計値が発表されました。
65歳以上の高齢者のうち認知症の人は推計15%であり、85歳以上では4割を超えることが報告されております。高齢化社会の加速により、認知症の発症率は年々増加しているのが現状です。
認知症の最大のリスクは、「加齢」です。超高齢社会においては、認知症は「ありふれた疾患」の一つになっているのが現状なのです。
エスポアール出雲クリニック(島根県)の高橋幸男院長は、認知症高齢者の方には以下のようなお話をしているそうです(一部改変)。
「はじめに、『年をとったらもの忘れが多くなる』という一般的な話を筆者自身の体験談を交えてひとしきりする。そして『認知症は、年をとったら誰でもなり得る病気』と話す。認知症になった有名人(故レーガン元大統領など)の話をしながら、『高齢社会になって認知症になる人は多い』。実際に、『90歳まで生きたら2人に1人』とか『100歳で70%以上』などと伝える」。同伴した家族にも『あなたも明日はわが身』と話す。こうした認識は、昔は皆が持っていた共通感覚であり、認知症高齢者に安堵感を生み出す。認知症の告知でもあるが、それまで、表情を硬くし物忘れや認知症を否定しようとしていた高齢者も多少表情が和んでくる。」(高橋幸男:認知症をいかに本人と家族に伝えるか. 治療 Vol.89 2994-3000 2007)
「90歳まで生きたら2人に1人」という記述を読まれて有病率の高さに驚かれた方も多いのではないでしょうか。
不安を煽らないように少なめの数字を採択することも時と場合によっては必要かも知れません。しかし、認知症に対する「対策」をより一層推進するために、多めの数字も隠さずに周知徹底していくことも大切なことだと思います。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第223回『親がアルツハイマー病、私の将来はどうかな!─「ありふれた疾患」であり「明日はわが身」』(2013年8月10日公開)
鳥取大学医学部脳神経医科学講座脳神経内科学分野の中島健二教授は、「わが国の65歳以上の方の認知症の有病率は、人口の急速な高齢化に伴い年々増加しており、1990年代後半から2000年代にかけ8%を上回る報告がなされ、最近では10%を超える報告もあります。有病率が上昇した背景には、人口の高齢化のほか、認知症に対する一般の注目度が高まり、早期に医療機関を受診する方が増加したことなども一因と考えられます。」と指摘しております(中島健二 他:座談会─高齢者のアルツハイマー型認知症治療における課題と展望. Geriat Med Vol.49 815-824 2011)。
実は、2009~2010年度に認知症の有病率等に関する調査が小自治体中心に実施されております(朝田 隆:認知症の実態把握に向けた総合的研究. 厚生労働科学研究費補助金[長寿科学総合研究事業]総合研究報告書、2011)。2011年8月に発行されましたメディカル朝日(Medical ASAHI 2011 August 19-20)は、このデータを以下のように紹介しております(一部改変)。
「筑波大学臨床医学系精神医学の朝田隆教授らは、最近全国7カ所(宮城県栗原市、茨城県利根町、愛知県大府市、島根県海士町、大分県杵築市、佐賀県伊万里市黒川町、新潟県上越市)で、65歳以上住民を対象として晩発性認知症の疫学を調査した。訪問調査員と専門医による診察を基本としてMRIによる撮像を実施する3次調査も行うことで高い精度の診断と評価を目指した。…(中略)…2008年の日本の人口に準拠して推定された65歳以上の住民における認知症有病率は12.4~19.6%(平均で14.4%)であった。…(中略)…認知症有病率は65~69歳以降、5歳刻みにほぼ倍増し、85~89歳では3人に1人の割合になっていくことが分かった。」
前述のデータにおいては、95~99歳の認知症有病率は77.7%となっております。認知症はまさに「ありふれた疾患」であり「明日はわが身」と捉え、認知症介護者の気持ちに共感しながら対応を模索していくことが喫緊の課題なのです。調査においては、100~104歳の認知症有病率に関しては報告されておりませんでしたので直接朝田隆教授にお伺いしたところ、朝田隆教授の印象としては、「100~104歳の認知症有病率は少ないだろう」とのご意見でした。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第224回『親がアルツハイマー病、私の将来はどうかな!─百寿者の脳は元気!』(2013年8月11日公開)
David Snowdon(米国の神経病理学者)の著書『100歳の美しい脳』(デヴィッド・スノウドン著, 藤井留美訳, DHC, 2004)には有名なナンスタディの詳細が記載されており、そのp276には「アルツハイマー病は年齢とともに増加し、頂点(95歳?)に達したあとで減少に転じる」という記載があります。
すなわち、95歳頃まで認知症の発症を予防することができれば、認知症に打ち勝てるのではないかとも考えられているのです。
実際に百寿者の脳病理所見においては、アルツハイマー病変はさほど多くないことも報告されているのです。
「筆者の勤務する高齢者専門病院(浴風会病院)で、1984年以降に病理解剖させていただいた方がたのうち、百寿者32名(男性2名、女性30名、平均年齢101.5歳)の脳を調査しました。その結果、アルツハイマー病の可能性が高い(ブラーク・ステージ5以上)と判定されたのは7例(21.9%)、境界域(ステージ3~4)が21例(65.6%)、正常加齢範囲内(ステージ2以下)が4例(12.5%)でした。全体的な傾向として、記憶と関連する部位(海馬およびその周辺)にはアルツハイマー病に匹敵する多量のNFTが認められますが、前頭葉など高度の認知機能を司る部位には少量にとどまっていました。100歳に達しても、もの忘れを生じる程度の変化は現れるものの、典型的なアルツハイマー病と診断できるほどの病変は容易には生じないという印象でした。アルツハイマー病はあくまでも病的な状態であって、生理的な老化過程の延長とは一線を画していると考えたほうがよさそうです。」(伊藤嘉憲:100歳以上になれば、ほとんどの人はアルツハイマー病になりますか? からだの科学通巻278号 46 2013)
NFTについても説明しておきます。シリーズ第181回『アルツハイマー病を治す薬への道 神経原線維変化をターゲットすれば?』において、「多くの神経病理学者が以前から主張するように、アミロイド蓄積のみでは認知機能は正常である。これは、アミロイドポジトロン断層撮影(PET)の導入により、Alzheimer Disease Neuroimaging Initiative(ADNI)でも実証された。正常高齢者の30~50%がすでにアミロイドPET陽性である! ヒトでは認知機能低下は、アミロイド蓄積(老人斑)ではなく、神経細胞脱落の程度および神経原線維変化の密度と相関する。アミロイド→神経原線維変化の因果関係は存在するが、その連鎖は強くなく緩やかである、ということなのであろう。ということは、認知機能低下に直接的な原因である、神経原線維変化形成のみをターゲットとした治療法がありうるということでもある(井原康夫:アルツハイマー病における未解決の問題点. 最新医学 Vol.66・9月増刊号 2079-2085 2011)」という内容の論文をご紹介しましたね。ここで登場した「神経原線維変化」がneurofibrillary tangle(NFT)なのです。
アルツハイマー病は、高齢になればなるほど認知症全体に占める割合が増加します。デンマークのオーデンス大学の調査では、80~84歳に発症する認知症の約90%がアルツハイマー病でした。
ですから、両親のどちらかがアルツハイマー病であるというケースは決して稀ではないのです。
さて、このシリーズの冒頭でご紹介した40代女性の方は、アルツハイマー病の遺伝を心配してメールを送ってこられたようです。
Facebookコメント
神経原線維変化がなぜ起きるのかは解明されていませんが、いくつかわかっていることがあります。
まず、神経原線維変化の前段階である悪いタウタンパク質は、嗅内野の手前の青斑核という部分に最初に溜まるということです。3歳児の脳の青斑核にも悪いタウタンパク質は見つかっており、20歳くらいの人でも半数には見られるといいます。
嗅内野に神経原線維変化が生じても、まだ認知機能は正常に保たれています。しかし海馬から大脳辺縁系へと神経原線維変化が広がって、それぞれの部位に障害が生じると、日々の出来事の前後関係がわからなくなったり、海馬に一時的に保存した記憶を引き出すことができなくなったりします。
さらに神経原線維変化が大脳新皮質へと広がれば、情報を分析・判断したり、長期記憶を保存したりする部分にも障害が生じます。ここまで進んだ方は、明確にアルツハイマー病と診断される段階にあると言えます。
「嗅内野というところに神経原線維変化が生じるとボケる」と早合点した方もいらっしやるかもしれません。
しかし、神経原線維変化というのは誰にでも現れるものであり、嗅内野にできることは、正常な老化だと言えます。
加齢に伴う神経原線維変化の広がりについてドイツの解剖学者であるブラーク博士らが3508人を対象にして調べた結果では、嗅内野に神経原線維変化が生じる「ブラークステージⅠ、Ⅱ」の段階には、30代前半で約2割、60代前半なら約6割、75歳では約7割の人が達していることがわかります。なお、神経原線維変化がさらに広がってボケを発症する段階にある「ブラークステージⅢ、Ⅵ」の人は75歳で約2割いますから、両方を合わせると、75歳では9割の人の嗅内野に神経原線維変化があるということです。
【髙島明彦:淋しい人はボケる─認知症になる心理と習慣 幻冬舎, 東京, 2014, pp68-72】
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第225回『親がアルツハイマー病、私の将来はどうかな!─家族性と判明しても治療法がない』(2013年8月12日公開)
家族性のアルツハイマー病って多いのでしょうか?
64歳までに発症するものを初老期認知症と呼んでいます。そして遺伝子変異が原因となって発症する浸透率の高い家族性アルツハイマー病(遺伝性アルツハイマー病)は、基本的にはすべて早発型(60歳ないし65歳以前に発症)です(認知症テキストブック 中外医学社, 東京, 2008, p234)。
では家族性アルツハイマー病の頻度はどの程度なのでしょうか。
アルツハイマー病の約95%は老年期(65歳以降)に発症しており、初老期発症のアルツハイマー病は、人口10万人あたり20人程度です。そして初老期発症のアルツハイマー病のうちの約10%が家族性アルツハイマー病です。
すなわち家族性アルツハイマー病は、アルツハイマー病全体の約5%程度である初老期発症アルツハイマー病の約10%に過ぎないわけですから、極めて稀な疾患と考えられますね。
遺伝性の強い家族性アルツハイマー病は、世界中で百数十家系と報告されています(一宮洋介:認知症の臨床─最新治療戦略と症例 メディカル・サイエンス・インターナショナル, 東京, 2013, p23)。家族性アルツハイマー病の代表は、「プレセニリン1(presenilin 1;PS1)」という遺伝子変異によるもので、多くは30~50歳代で発症します。
もう理解して頂けたとは思いますが、相談メールを送ってこられた女性のお母さんがアルツハイマー病を発症したのは70歳代です。初老期発症ではありませんので、家族性アルツハイマー病ということは基本的には考えられないわけですね。
ではもし親のアルツハイマー病発症年齢が30~50歳代であった場合には、遺伝子検査を受けた方が良いのでしょうか? アルツハイマー病の遺伝子検査を希望される方に対しては、十分なカウンセリングが必要です。そして、以下のような説明がなされ十分に理解してもらうことが不可欠です。 1 アルツハイマー病の大半は、家族性ではなく弧発性に発症すること 2 アルツハイマー病の原因遺伝子が、すべて解析されたわけではないこと 3 家族性であることが判明しても、今のところ治療法がないこと
きちんと説明すれば、アルツハイマー病の遺伝子検査を希望される方は概ね皆無なのですが、調べたいという意思に揺らぎがないのでしたら、信州大学医学部附属病院など「遺伝性神経疾患に対する遺伝子診断と遺伝カウンセリング」に応じている医療機関もありますのでお問い合わせ下さい(http://wwwhp.md.shinshu-u.ac.jp/patient/calendar_saishin.php)。
繰り返しますが、上記3の「家族性であることが判明しても、今のところ治療法がないこと」という点は十分にご理解下さいね。
神戸大学医学部附属病院・認知症疾患医療センターの山本泰司講師(精神科神経科)がアルツハイマー病の遺伝子診断に関して記述しているサイト(http://www.senshiniryo.net/column_a/23/index.html)におきましては、遺伝子診断の検査の対象に関して以下のように記載されています。
「検査の対象となるのは、問診や認知機能検査、脳の画像診断などからアルツハイマー病と診断され、しかも発症年齢が若く、両親・兄弟や叔父・叔母など3親等以内に複数の患者が認められるケースとなります。」
Facebookコメント
「家族性アルツハイマー病が、アルツハイマー病の原因を解明する上で、最も重要な鍵となることは言うまでもない。家族性アルツハイマー病の課題は多岐にわたる。まず、患者の多くは早期発症型であるため、一家の大黒柱や家事の中心となる人の発病による家庭生活への影響は計り知れず、その困難さは、このような限られた誌面では語り尽くせない。そのうえ遺伝病という拭いようのない重圧と不安、苦しみの深刻さが加わるわけで、この難病を言葉で表すことは不可能である。アルツハイマー病の中でも最も困難な状況である家族性アルツハイマー病に手を差し延べることができれば、アルツハイマー病における医療上の問題を解決するための大きな一歩を踏み出せることになる。家族性アルツハイマー病は、症例数が少ない故に重要性が低いということは決してなく、むしろ家族性アルツハイマー病に正面から取り組むことで、99%以上を占める孤発性アルツハイマー病の対策への真の道が開けてくると言っても過言ではない。
昨年2012年にThe New England Journal of Medicineに発表されたDIAN研究は早期発症型家族性アルツハイマー病の未発症者を対象とした初めての多施設共同臨床研究である。研究方式としては比較的小規模での横断的研究であるが、各家系の遺伝的背景の均質性で補填することで、同一被験者(群)を長期間解析する縦断的研究の要素を組み入れることに成功した点で画期的な発想を持つ臨床研究である。早期診断、早期治療介入が理想的と考えられている一般的な孤発性アルツハイマー病治療において、発症時期を予測できることは容易ではなく、発症時期を高い確度で推定可能な家族性アルツハイマー病での薬剤介入臨床試験は極めて重要な鍵となる知見を与えてくれることが期待される。DIAN研究によって、発症がまさにスタートするタイミングで治験薬剤を効率よく投与することは、医療費と薬剤身体負荷、そして薬剤有効性のあらゆる面でプラスに作用するばかりではなく、発病を食い止める臨床試験の質の向上にとっても重要である。」(森 啓、東海林幹夫、池田将樹、池内 健、岩坪 威、嶋田裕之:Dominantly Inherited Alzheimer's Network(DIAN)研究について. Dementia Japan Vol.28 116-126 2014)
DIAN(Dominantly Inherited Alzheimer's Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』のコメント欄において紹介しておりますのでご参照下さい。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第226回『親がアルツハイマー病、私の将来はどうかな!─家族性アルツハイマー病の定義』(2013年8月13日公開)
ウィキペディア(http://ja.wikipedia.org/wiki/%E3%82%A2%E3%83%AB%E3%83%84%E3%83%8F%E3%82%A4%E3%83%9E%E3%83%BC%E5%9E%8B%E8%AA%8D%E7%9F%A5%E7%97%87)を読みますと、「家族性アルツハイマー病では、原因遺伝子としては4種類が知られており、21番染色体のアミロイド前駆体蛋白遺伝子、14番染色体のプレセニリン1遺伝子、1番染色体のプレセニリン2遺伝子、19番染色体のアポリポ蛋白E遺伝子のいずれかが変異を起こすと家族性アルツハイマー病が発症する。」と記載されております。
しかしながら専門的には、特定の遺伝子変異を持つことによりアルツハイマー病をほぼ100%発病する原因遺伝子によるものを家族性アルツハイマー病と呼んでおり、第21染色体上のアミロイド前駆体タンパク遺伝子(APP)、第14染色体上のプレセニリン1遺伝子(PS1)、第1染色体上のプレセニリン2遺伝子(PS2)の3つが原因遺伝子として知られています(認知症テキストブック 中外医学社, 東京, 2008, p234)。なお、家族性アルツハイマー病(遺伝性アルツハイマー病)は、基本的にはすべて早発型(60歳ないし65歳以前に発症)ですと先程述べておりますが、プレセニリン2遺伝子によるものは若干発症年齢が高いことも知られております(http://www.jfnm.or.jp/nl/news05/news5hp4-10.pdf)。プレセニリン2遺伝子によるものは頻度的には少なく、「Presenilin-1の変異では若年発症アルツハイマー病の30~70%、presenilin-2では5%以下で、APP変異は10~15%」(編集/朝田 隆 著/山田達夫:認知症診療の実践テクニック─患者・家族にどう向き合うか医学書院, 東京, 2011, pp3-4)といわれています。
シリーズ第81回『アルツハイマー病の予防 DHAが効く人もいるけど、別の問題も』のメモ2において述べましたように、アポリポ蛋白E4(遺伝子型はε4=イプシロン4)は、AD発症の危険性を高める感受性遺伝子であり、アルツハイマー病(AD)最大の危険因子と考えられていましたね。
少しだけ要点を復習しておきましょうね(山田達夫:認知症診療の実践テクニック─患者・家族にどう向き合うか医学書院, 東京, 2011, pp3-4)。
「singleε4ではε3/ε3を基準にした場合3.2倍、ε4/ε4では11.6倍発症率が高まるといわれる。しかし、ApoEは遺伝的素因の50%程度を説明しているにすぎず、それ以外の遺伝的危険因子の解析が進行している。」
50%ではなく、もっと少ないという意見もあります。新潟大学脳研究所附属生命科学リソース研究センター(http://www.bri.niigata-u.ac.jp/~idenshi/)遺伝子機能解析学の桑野良三教授らは、「孤立性ADの遺伝的リスクとしてApoEε4が民族を超えて認められています。しかし、ApoEε4遺伝型で説明できるのは20%程度とされ、残るリスク遺伝子の探索が精力的に行われています。」(温 雅楠、桑野良三:アルツハイマー病と遺伝. からだの科学通巻278号 8 2013)と報告しています。
Facebookコメント
Medical Tribuneの2013年8月15日号(Vol.46 No.33 p2)において、「ADの家族歴ある者で高い無症候性の脳内プラーク蓄積リスク─家族歴ない者と比べリスクが2倍以上」(http://mtpro.medical-tribune.co.jp/mtnews/2013/M46330022/)というニュースが伝えられました。極めて重要な報告でありますので、以下に抜粋してご紹介しましょう。
「デューク大学(ダーラム)精神医学・内科学のP. Murali Doraiswamy教授らは、第1度親族にアルツハイマー病(AD)患者がいると、こうした家族歴がない者と比べADに関連した無症候性の脳内プラーク蓄積リスクが2倍以上高まることが分かったとPLoS One(2013;8:e60747)に発表した。
家族歴は遅発性ADの危険因子と予測因子であることが既に知られており、第1度親族(父母・兄弟姉妹)にAD患者がいる場合の発症リスクは2~4倍になることが複数の研究で示唆されている。第1度親族間の遺伝子共有は約50%とされている。ADの遺伝因子のうち約50%は、APOE遺伝子型や一般的な遺伝的変異が占めているが、他の遺伝的原因はまだ解明されていない。
研究責任者のDoraiswamy教授は『今回の研究では、家族歴は陽性だが、それ以外は正常か軽度の物忘れがあるだけの人でも、無症候性のアミロイドプラーク蓄積が起こるかどうかを検討した』と述べている。
同教授と同大学神経科学部門の研究生であるErika J. Lampert博士らは、バイオマーカーを用いてAD進行の定義を検討している全米研究Alzheimer's Disease Neuroimaging Initiativeの一環として、さまざまなレベルの認知機能障害患者と認知機能正常者を含む成人257例(55〜89歳)のデータを分析。年齢、性、AD家族歴などのデータを収集した。家族歴陽性は、親か兄弟姉妹のいずれかにAD患者がいる者と定義した。次に、こうした情報を、認知機能評価やAPOE遺伝子型解析、MRIによる海馬容積の測定、脳脊髄液中の3種類の病理学的マーカー〔アミロイドβ(Aβ)42、総タウ蛋白(t-tau)、t-tau/Aβ42比〕などの生物学的検査結果と照合した。
家族歴のある者では、予想通りADリスクと早期発症リスクの上昇に関連するAPOE遺伝子の発現が亢進していた。さらに、家族歴のある者では、家族歴のない者との生物学的な差が他にも見られたことから、まだ発見されていない遺伝的因子が認知症発症前のAD進行に影響を与えている可能性が示唆された。家族歴陽性の健康人の約半数は、脳脊髄液測定に基づく前臨床的ADの基準を満たしたが、家族歴のない者でこの基準を満たしたのは約20%のみだった。」
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第227回『親がアルツハイマー病、私の将来はどうかな!─危険因子の有無を調べても……』(2013年8月14日公開)
プレセニリン1(presenilin 1;PS1)といった家族性アルツハイマー病の原因遺伝子ではないものの、危険因子(アポリポ蛋白E4)の有無を調べて欲しいと希望される方は、私の外来にもちょくちょく来られます。
シリーズ第12回『認知症の診断─もの忘れ検診』において、私が1996年7月9日に国内で初めて開設した「認知症の検診」についてご紹介しましたね(笠間 睦:痴ほう専門ドックの開設. 脳神経 Vol.49 195 1997)。この「痴ほう専門ドック」において実施していた検査項目の1つには、実はアポリポ蛋白E4の採血検査も含まれておりました。
しかし今は、「アポリポ蛋白E4の保有が分かっても、今のところ治療法がないこと」をきちんと説明し検査は実施しておりません。
現在においても、アポリポ蛋白Eのフェノタイプ(http://www.sms.co.jp/reference/detail.php?PHPSESSID=1b39391eb0cd02366cc6e6f6ce9868cf&pos=28&s=1532&PHPSESSID=1b39391eb0cd02366cc6e6f6ce9868cf)を調べているいる医療機関は多数あります。しかしながらその目的は、家族性脂質異常症の精査目的(http://www.mh.nagasaki-u.ac.jp/kensa/news/225.pdf)であり、アルツハイマー病の危険因子をチェックする目的で実施されているわけではありません。
ApoEには主にE2、E3、E4の3つの表現型があり、E2/E2はLDL受容体への結合能が著しく低下しておりⅢ型家族性脂質異常症を呈する可能性があります(蔵野 信、木下 誠:アポリポ蛋白とリポ蛋白分画. medicina Vol.50 978-981 2013)。Ⅲ型家族性脂質異常症については、ウィキペディア(http://ja.wikipedia.org/wiki/%E8%84%82%E8%B3%AA%E7%95%B0%E5%B8%B8%E7%97%87)などをご参照下さい。
日本医学会が2011年2月に発表した「医療における遺伝学的検査・診断に関するガイドライン」(http://jams.med.or.jp/guideline/genetics-diagnosis.pdf)においては、「被検者の診断結果が血縁者の健康管理に役立ち、その情報なしには有効な予防や治療に結びつけることができないと考えられる場合には、血縁者等に開示することも考慮される。その際、被検者本人の同意を得たのちに血縁者等に開示することが原則である。例外的に、被検者の同意が得られない状況下であっても血縁者の不利益を防止する観点から血縁者等への結果開示を考慮する場合がありうる。この場合の血縁者等への開示については、担当する医師の単独の判断ではなく、当該医療機関の倫理委員会に諮るなどの対応が必要である。」と規定されており、個人の遺伝情報の開示にあたっては各医療機関の倫理委員会などでの協議も必要となります。
2013年6月14日号の週刊ポスト(通巻2233号)では、「医療最前線─ここまでわかった・ボケる遺伝子」という特集が組まれましたね。タイトル誘われついつい買ってしまいました。不安を煽るだけではなく、きちんと情報開示のことに踏み込んで記載しておりました。その部分を以下にご紹介しましょう。
「アポE4とアルツハイマー病の発症リスクの相関関係は強い。そのため、検査結果の告知には、十分な配慮がなされている。多くの病院や検査機関では、検査対象者にその結果を知る重要性をきちんと伝え、同意が得られた場合のみ結果を示す。」(週刊ポスト通巻第2233号, 142-146, 2013)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第228回『親がアルツハイマー病、私の将来はどうかな!─予防的治療薬を与える大規模な研究』(2013年8月15日公開)
アルツハイマー病の原因遺伝子を保有するキャリアに対して、未発症の段階から早期介入または予防的治療薬投与を試みる大規模な研究が進められており、東北大学加齢医学研究所老年医学分野の荒井啓行教授がその概略について言及しております(岩坪 威、荒井啓行、井原康夫:座談会─アルツハイマー病. Current Therapy Vol.30 360-368 2012)。その概要と今後の展望についてご紹介し本稿を閉じたいと思います。
「Alzheimer's Prevention Initiative(API)による臨床研究は、南米のコロンビアにあるアンティオキアという町を舞台にした介入研究の計画です。そこに、あるファウンダー(創始者)から発したと思われるPS-1遺伝子変異の非常に大きな家系があります。その家系の現存者1,235名のうち、480名がミューテーション(変異)をもちながら、まだ発症していないキャリアであり、ミューテーション陽性者の平均発症年齢は48歳であることがわかっています。このキャリアの方を対象に、おそらく20代、30代あたりから、疾患修飾薬による治療を脳脊髄液のAβやアミロイドPETなどのバイオマーカーを用いて追跡しながら行うのです。つまり、アミロイドの蓄積を一度リセットし、アミロイドの全くない脳に戻したときに、はたして発症年齢をどれだけ遅らせることができるかを検討する壮大な研究計画です。」(一部改変)
筑波大学臨床医学系精神医学の朝田隆教授はこの研究について、「Alzheimer's Prevention Initiativeによる臨床研究では、ADを早期に発症する希少な遺伝子変異をもつ大家族で、Genentech社による治療薬crenezumabの効果が試されています。ここでは300名の未発症に人において、従来は避けられなかった認知機能低下に歯止めをかけられるか否か、また発症を遅くすることができるか否かが、5年間の追跡調査により調べられます(Miller G:Alzheimer's research. Stopping Alzheimer's before it starts. Science Vol.337 790-792 2012)。」(朝田 隆:アルツハイマー病の発症予防法の開発. からだの科学通巻278号 161-165 2013)と述べております。
そして、APIの他にも、DIAN(Dominantly Inherited Alzheimer Network)、A4(Anti-Amyloid Treatment in Asymptomatic AD Trial)といった研究組織が有望な検討を模索しております(http://211.144.68.84:9998/91keshi/Public/File/41/337-6096/pdf/790.full.pdf)。
DIANは、既知3タイプのAD原因遺伝子によって生じる早発性ADを研究するために2008年に設立された組織です。
なお、A4の研究対象は、70歳以上でPETによるアミロイドイメージングにて陽性であるが認知機能は正常な人(preclinical AD)であり、Aβを減少させることにより後続する神経細胞死へと至る流れに歯止めをかけられるか否かを検証することを主目的としており、DIANとは異なり、遺伝性ではない弧発性のアルツハイマー病の病理進行に注目して治療介入を目指すものです。
なお、A4研究(http://www.alzforum.org/new/detail.asp?id=3379)におきましては、シリーズ第189回『アルツハイマー病を治す薬への道─アルツハイマー病は3型糖尿病』のコメント欄およびシリーズ第95回『アルツハイマー病の治療薬─アルツハイマー病根本治療薬の姿』においてご紹介しましたsolanezumab(ソラネズマブ)の効果が試されます。
Facebookコメント
「米国は、『2025年までに効果的な予防と治療法の開発を達成する』と国家的に取り組むことを明確に打ち出した。NIA(National Institute for Aging)が主導して、ADGCとADNIが受け皿となってADSP(Alzheimer's Disease Sequencing Project=https://www.niagads.org/adsp)が進行している。家族性AD100家系以上を対象とした全ゲノムシークエンス並びにAD5,000人とその対照群5,000人の全エクソーム解析が、2013年3月に開始され2015年12月に終了する。これらのプロジェクトは、研究成果を共有して効率的な解析を推進すること基本としている。日本も先導的にこれらの国際共同研究に早く参加しなければ、またしても後手にまわり、単に日本人のデータを提供する隷属研究に陥るであろう。」(桑野良三、月江珠緒:アルツハイマー病診断における遺伝子・バイオマーカーの意義. Dementia Japan Vol.27 334-343 2013)
Facebookコメント
A4研究:
「抗アミロイド抗体による加療により、3年後にバイオマーカーにどのような変化が生じるかを検討するのがA4研究である。すなわち上流にあるアミロイド蓄積を抗体療法によって減らすことにより、下流にある神経細胞死や認知機能低下を予防できないか検討する試験である。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
Facebookコメント
「APIは、南米コロンビアに住む地域住民に多く認められるPSEN1遺伝子にE280A変異を有する早発型家族性アルツハイマー病(early onset familial Alzheimer disease;EOFAD)患者を対象にAβ抗体であるcrenezumabによる抗体療法の効果を検証する試験である。
本家系は25年以上前にコロンビアのアンティオキア大学のLoperaらにより発見されたもので、現在5,000人以上が北コロンビアの山岳地帯に住んでいる。本家系の症状の特徴は早発であるということを除けば、記憶障害で発症することなど、全体的な症状は孤発性のアルツハイマー病とよく似ている。平均発症年齢は47歳である。本家系の多くのキャリアは30代前半で、他に症状がなくても記憶障害を捉えることができるという。本研究では認知機能検査で異常がないと確認された30歳以上のキャリアが試験にリクルートされる。本家系では30歳以上のキャリアなら、既に脳内にはアミロイドの沈着が認められる。
昨年末、本家系の中で未発症である18~26歳の20人においてDIAN研究と同様のバイオマーカーの比較研究を行った結果が発表された(文献20, 21)。その結果、髄液のAβ42はDIAN研究と同様に、遺伝子変異を有するキャリアにおいて当初有意な上昇が認められた。頭部MRIでは既に頭頂部および頭頂側頭部の灰白質に萎縮が認められ、fMRIでは海馬の活性化と両側の後部帯状回の非活性化が認められた(文献20)。
また、同時に発表されたアミロイドPET研究では、20~56歳を対象として、遺伝子変異を有するキャリア11人(認知症4人、MCI7人)、未発症キャリア19人、非キャリア20人のアミロイド蓄積量を比較している。その結果、非キャリア群に比べ、未発症キャリア群は有意に蓄積量が多いことが認められた。さらに、3群のデータから、アミロイド蓄積量が発症前から経年的に増加し、プラトーに達した後MCI、認知症へと進行していくことが示された(文献21)。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
参考文献:
20)Reiman EM,Quiroz YT,Fleisher AS et al:Brain imaging and fluid biomarker analysis in young aduls at genetic risk for autosomal dominant Alzheimer's disease in the presenilin 1 E280A kindred: a case-control study. Lancet Neurol Vol.11 1048-1056 2012
21)Fleisher AS,Chen K,Quiroz YT et al:Florbetapir PET analysis of amyloid-beta deposition in the presenilin 1 E280A autosomal dominant Alzheimer's disease kindred: a cross-sectional study. Lancet Neurol Vol.11 1057-1065 2012
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(http://apital.asahi.com/article/kasama/2013032800005.html)のコメント欄において紹介しておりますのでご参照下さい。
Facebookコメント
「遺伝的な要因で発症する『家族性アルツハイマー病』の人たちが国内にどれだけいるか、実態調査を厚生労働省の研究チームが2013年11月から始める。結果をもとにまだ症状のない家族性の人に薬を使って発症を防ぐ試みにつなげたい考えだ。」
若年認知症の方より時折、「遺伝子検査」を受けた方が良いかどうかを質問されることがあります。
アピタルでそれに関して言及しておりますので以下にご紹介致します。
結論から言いますと、「家族性と判明しても治療法がない」(朝日新聞アピタル「ひょっとして認知症-PartⅡ」第225回)ということになります。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第222回『親がアルツハイマー病、私の将来はどうかな!─90歳まで生きたら2人に1人』(2013年8月9日公開)
メールで送信されてくる質問に、以下のような相談内容が時折あります。
「母が70代でアルツハイマー病を発症しました。自分もなるのでは…と心配です。物忘れが少しあります。早めに検査を受ける方が良いのでしょうか?」(40代女性)
早めに検査する方がよいのかどうかについてお話する前に、まずは認知症の有病率について考えてみましょう。
筑波大学附属病院・副病院長で筑波大学大学院人間総合科学研究科病態制御医学専攻神経病態医学分野(臨床医学系神経内科)の玉岡晃教授は、「本邦における65歳以上の高齢者における認知症の有病率は3.8~11.0%と報告されている」(玉岡 晃:認知症疾患ガイドライン─最新の現状─ Geriat Med Vol.49 749-754 2011)と述べています。
この報告にもありますように、ごく最近まで「認知症の有病率(65歳以上)は、4~8%」(認知症テキストブック 中外医学社, 東京, 2008, pp12-13)と考えられてきました。
しかし、2013年6月1日付朝日新聞1面トップニュースにおいて、最新の認知症高齢者推計値が発表されました。
65歳以上の高齢者のうち認知症の人は推計15%であり、85歳以上では4割を超えることが報告されております。高齢化社会の加速により、認知症の発症率は年々増加しているのが現状です。
認知症の最大のリスクは、「加齢」です。超高齢社会においては、認知症は「ありふれた疾患」の一つになっているのが現状なのです。
エスポアール出雲クリニック(島根県)の高橋幸男院長は、認知症高齢者の方には以下のようなお話をしているそうです(一部改変)。
「はじめに、『年をとったらもの忘れが多くなる』という一般的な話を筆者自身の体験談を交えてひとしきりする。そして『認知症は、年をとったら誰でもなり得る病気』と話す。認知症になった有名人(故レーガン元大統領など)の話をしながら、『高齢社会になって認知症になる人は多い』。実際に、『90歳まで生きたら2人に1人』とか『100歳で70%以上』などと伝える」。同伴した家族にも『あなたも明日はわが身』と話す。こうした認識は、昔は皆が持っていた共通感覚であり、認知症高齢者に安堵感を生み出す。認知症の告知でもあるが、それまで、表情を硬くし物忘れや認知症を否定しようとしていた高齢者も多少表情が和んでくる。」(高橋幸男:認知症をいかに本人と家族に伝えるか. 治療 Vol.89 2994-3000 2007)
「90歳まで生きたら2人に1人」という記述を読まれて有病率の高さに驚かれた方も多いのではないでしょうか。
不安を煽らないように少なめの数字を採択することも時と場合によっては必要かも知れません。しかし、認知症に対する「対策」をより一層推進するために、多めの数字も隠さずに周知徹底していくことも大切なことだと思います。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第223回『親がアルツハイマー病、私の将来はどうかな!─「ありふれた疾患」であり「明日はわが身」』(2013年8月10日公開)
鳥取大学医学部脳神経医科学講座脳神経内科学分野の中島健二教授は、「わが国の65歳以上の方の認知症の有病率は、人口の急速な高齢化に伴い年々増加しており、1990年代後半から2000年代にかけ8%を上回る報告がなされ、最近では10%を超える報告もあります。有病率が上昇した背景には、人口の高齢化のほか、認知症に対する一般の注目度が高まり、早期に医療機関を受診する方が増加したことなども一因と考えられます。」と指摘しております(中島健二 他:座談会─高齢者のアルツハイマー型認知症治療における課題と展望. Geriat Med Vol.49 815-824 2011)。
実は、2009~2010年度に認知症の有病率等に関する調査が小自治体中心に実施されております(朝田 隆:認知症の実態把握に向けた総合的研究. 厚生労働科学研究費補助金[長寿科学総合研究事業]総合研究報告書、2011)。2011年8月に発行されましたメディカル朝日(Medical ASAHI 2011 August 19-20)は、このデータを以下のように紹介しております(一部改変)。
「筑波大学臨床医学系精神医学の朝田隆教授らは、最近全国7カ所(宮城県栗原市、茨城県利根町、愛知県大府市、島根県海士町、大分県杵築市、佐賀県伊万里市黒川町、新潟県上越市)で、65歳以上住民を対象として晩発性認知症の疫学を調査した。訪問調査員と専門医による診察を基本としてMRIによる撮像を実施する3次調査も行うことで高い精度の診断と評価を目指した。…(中略)…2008年の日本の人口に準拠して推定された65歳以上の住民における認知症有病率は12.4~19.6%(平均で14.4%)であった。…(中略)…認知症有病率は65~69歳以降、5歳刻みにほぼ倍増し、85~89歳では3人に1人の割合になっていくことが分かった。」
前述のデータにおいては、95~99歳の認知症有病率は77.7%となっております。認知症はまさに「ありふれた疾患」であり「明日はわが身」と捉え、認知症介護者の気持ちに共感しながら対応を模索していくことが喫緊の課題なのです。調査においては、100~104歳の認知症有病率に関しては報告されておりませんでしたので直接朝田隆教授にお伺いしたところ、朝田隆教授の印象としては、「100~104歳の認知症有病率は少ないだろう」とのご意見でした。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第224回『親がアルツハイマー病、私の将来はどうかな!─百寿者の脳は元気!』(2013年8月11日公開)
David Snowdon(米国の神経病理学者)の著書『100歳の美しい脳』(デヴィッド・スノウドン著, 藤井留美訳, DHC, 2004)には有名なナンスタディの詳細が記載されており、そのp276には「アルツハイマー病は年齢とともに増加し、頂点(95歳?)に達したあとで減少に転じる」という記載があります。
すなわち、95歳頃まで認知症の発症を予防することができれば、認知症に打ち勝てるのではないかとも考えられているのです。
実際に百寿者の脳病理所見においては、アルツハイマー病変はさほど多くないことも報告されているのです。
「筆者の勤務する高齢者専門病院(浴風会病院)で、1984年以降に病理解剖させていただいた方がたのうち、百寿者32名(男性2名、女性30名、平均年齢101.5歳)の脳を調査しました。その結果、アルツハイマー病の可能性が高い(ブラーク・ステージ5以上)と判定されたのは7例(21.9%)、境界域(ステージ3~4)が21例(65.6%)、正常加齢範囲内(ステージ2以下)が4例(12.5%)でした。全体的な傾向として、記憶と関連する部位(海馬およびその周辺)にはアルツハイマー病に匹敵する多量のNFTが認められますが、前頭葉など高度の認知機能を司る部位には少量にとどまっていました。100歳に達しても、もの忘れを生じる程度の変化は現れるものの、典型的なアルツハイマー病と診断できるほどの病変は容易には生じないという印象でした。アルツハイマー病はあくまでも病的な状態であって、生理的な老化過程の延長とは一線を画していると考えたほうがよさそうです。」(伊藤嘉憲:100歳以上になれば、ほとんどの人はアルツハイマー病になりますか? からだの科学通巻278号 46 2013)
NFTについても説明しておきます。シリーズ第181回『アルツハイマー病を治す薬への道 神経原線維変化をターゲットすれば?』において、「多くの神経病理学者が以前から主張するように、アミロイド蓄積のみでは認知機能は正常である。これは、アミロイドポジトロン断層撮影(PET)の導入により、Alzheimer Disease Neuroimaging Initiative(ADNI)でも実証された。正常高齢者の30~50%がすでにアミロイドPET陽性である! ヒトでは認知機能低下は、アミロイド蓄積(老人斑)ではなく、神経細胞脱落の程度および神経原線維変化の密度と相関する。アミロイド→神経原線維変化の因果関係は存在するが、その連鎖は強くなく緩やかである、ということなのであろう。ということは、認知機能低下に直接的な原因である、神経原線維変化形成のみをターゲットとした治療法がありうるということでもある(井原康夫:アルツハイマー病における未解決の問題点. 最新医学 Vol.66・9月増刊号 2079-2085 2011)」という内容の論文をご紹介しましたね。ここで登場した「神経原線維変化」がneurofibrillary tangle(NFT)なのです。
アルツハイマー病は、高齢になればなるほど認知症全体に占める割合が増加します。デンマークのオーデンス大学の調査では、80~84歳に発症する認知症の約90%がアルツハイマー病でした。
ですから、両親のどちらかがアルツハイマー病であるというケースは決して稀ではないのです。
さて、このシリーズの冒頭でご紹介した40代女性の方は、アルツハイマー病の遺伝を心配してメールを送ってこられたようです。
Facebookコメント
神経原線維変化がなぜ起きるのかは解明されていませんが、いくつかわかっていることがあります。
まず、神経原線維変化の前段階である悪いタウタンパク質は、嗅内野の手前の青斑核という部分に最初に溜まるということです。3歳児の脳の青斑核にも悪いタウタンパク質は見つかっており、20歳くらいの人でも半数には見られるといいます。
嗅内野に神経原線維変化が生じても、まだ認知機能は正常に保たれています。しかし海馬から大脳辺縁系へと神経原線維変化が広がって、それぞれの部位に障害が生じると、日々の出来事の前後関係がわからなくなったり、海馬に一時的に保存した記憶を引き出すことができなくなったりします。
さらに神経原線維変化が大脳新皮質へと広がれば、情報を分析・判断したり、長期記憶を保存したりする部分にも障害が生じます。ここまで進んだ方は、明確にアルツハイマー病と診断される段階にあると言えます。
「嗅内野というところに神経原線維変化が生じるとボケる」と早合点した方もいらっしやるかもしれません。
しかし、神経原線維変化というのは誰にでも現れるものであり、嗅内野にできることは、正常な老化だと言えます。
加齢に伴う神経原線維変化の広がりについてドイツの解剖学者であるブラーク博士らが3508人を対象にして調べた結果では、嗅内野に神経原線維変化が生じる「ブラークステージⅠ、Ⅱ」の段階には、30代前半で約2割、60代前半なら約6割、75歳では約7割の人が達していることがわかります。なお、神経原線維変化がさらに広がってボケを発症する段階にある「ブラークステージⅢ、Ⅵ」の人は75歳で約2割いますから、両方を合わせると、75歳では9割の人の嗅内野に神経原線維変化があるということです。
【髙島明彦:淋しい人はボケる─認知症になる心理と習慣 幻冬舎, 東京, 2014, pp68-72】
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第225回『親がアルツハイマー病、私の将来はどうかな!─家族性と判明しても治療法がない』(2013年8月12日公開)
家族性のアルツハイマー病って多いのでしょうか?
64歳までに発症するものを初老期認知症と呼んでいます。そして遺伝子変異が原因となって発症する浸透率の高い家族性アルツハイマー病(遺伝性アルツハイマー病)は、基本的にはすべて早発型(60歳ないし65歳以前に発症)です(認知症テキストブック 中外医学社, 東京, 2008, p234)。
では家族性アルツハイマー病の頻度はどの程度なのでしょうか。
アルツハイマー病の約95%は老年期(65歳以降)に発症しており、初老期発症のアルツハイマー病は、人口10万人あたり20人程度です。そして初老期発症のアルツハイマー病のうちの約10%が家族性アルツハイマー病です。
すなわち家族性アルツハイマー病は、アルツハイマー病全体の約5%程度である初老期発症アルツハイマー病の約10%に過ぎないわけですから、極めて稀な疾患と考えられますね。
遺伝性の強い家族性アルツハイマー病は、世界中で百数十家系と報告されています(一宮洋介:認知症の臨床─最新治療戦略と症例 メディカル・サイエンス・インターナショナル, 東京, 2013, p23)。家族性アルツハイマー病の代表は、「プレセニリン1(presenilin 1;PS1)」という遺伝子変異によるもので、多くは30~50歳代で発症します。
もう理解して頂けたとは思いますが、相談メールを送ってこられた女性のお母さんがアルツハイマー病を発症したのは70歳代です。初老期発症ではありませんので、家族性アルツハイマー病ということは基本的には考えられないわけですね。
ではもし親のアルツハイマー病発症年齢が30~50歳代であった場合には、遺伝子検査を受けた方が良いのでしょうか? アルツハイマー病の遺伝子検査を希望される方に対しては、十分なカウンセリングが必要です。そして、以下のような説明がなされ十分に理解してもらうことが不可欠です。 1 アルツハイマー病の大半は、家族性ではなく弧発性に発症すること 2 アルツハイマー病の原因遺伝子が、すべて解析されたわけではないこと 3 家族性であることが判明しても、今のところ治療法がないこと
きちんと説明すれば、アルツハイマー病の遺伝子検査を希望される方は概ね皆無なのですが、調べたいという意思に揺らぎがないのでしたら、信州大学医学部附属病院など「遺伝性神経疾患に対する遺伝子診断と遺伝カウンセリング」に応じている医療機関もありますのでお問い合わせ下さい(http://wwwhp.md.shinshu-u.ac.jp/patient/calendar_saishin.php)。
繰り返しますが、上記3の「家族性であることが判明しても、今のところ治療法がないこと」という点は十分にご理解下さいね。
神戸大学医学部附属病院・認知症疾患医療センターの山本泰司講師(精神科神経科)がアルツハイマー病の遺伝子診断に関して記述しているサイト(http://www.senshiniryo.net/column_a/23/index.html)におきましては、遺伝子診断の検査の対象に関して以下のように記載されています。
「検査の対象となるのは、問診や認知機能検査、脳の画像診断などからアルツハイマー病と診断され、しかも発症年齢が若く、両親・兄弟や叔父・叔母など3親等以内に複数の患者が認められるケースとなります。」
Facebookコメント
「家族性アルツハイマー病が、アルツハイマー病の原因を解明する上で、最も重要な鍵となることは言うまでもない。家族性アルツハイマー病の課題は多岐にわたる。まず、患者の多くは早期発症型であるため、一家の大黒柱や家事の中心となる人の発病による家庭生活への影響は計り知れず、その困難さは、このような限られた誌面では語り尽くせない。そのうえ遺伝病という拭いようのない重圧と不安、苦しみの深刻さが加わるわけで、この難病を言葉で表すことは不可能である。アルツハイマー病の中でも最も困難な状況である家族性アルツハイマー病に手を差し延べることができれば、アルツハイマー病における医療上の問題を解決するための大きな一歩を踏み出せることになる。家族性アルツハイマー病は、症例数が少ない故に重要性が低いということは決してなく、むしろ家族性アルツハイマー病に正面から取り組むことで、99%以上を占める孤発性アルツハイマー病の対策への真の道が開けてくると言っても過言ではない。
昨年2012年にThe New England Journal of Medicineに発表されたDIAN研究は早期発症型家族性アルツハイマー病の未発症者を対象とした初めての多施設共同臨床研究である。研究方式としては比較的小規模での横断的研究であるが、各家系の遺伝的背景の均質性で補填することで、同一被験者(群)を長期間解析する縦断的研究の要素を組み入れることに成功した点で画期的な発想を持つ臨床研究である。早期診断、早期治療介入が理想的と考えられている一般的な孤発性アルツハイマー病治療において、発症時期を予測できることは容易ではなく、発症時期を高い確度で推定可能な家族性アルツハイマー病での薬剤介入臨床試験は極めて重要な鍵となる知見を与えてくれることが期待される。DIAN研究によって、発症がまさにスタートするタイミングで治験薬剤を効率よく投与することは、医療費と薬剤身体負荷、そして薬剤有効性のあらゆる面でプラスに作用するばかりではなく、発病を食い止める臨床試験の質の向上にとっても重要である。」(森 啓、東海林幹夫、池田将樹、池内 健、岩坪 威、嶋田裕之:Dominantly Inherited Alzheimer's Network(DIAN)研究について. Dementia Japan Vol.28 116-126 2014)
DIAN(Dominantly Inherited Alzheimer's Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』のコメント欄において紹介しておりますのでご参照下さい。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第226回『親がアルツハイマー病、私の将来はどうかな!─家族性アルツハイマー病の定義』(2013年8月13日公開)
ウィキペディア(http://ja.wikipedia.org/wiki/%E3%82%A2%E3%83%AB%E3%83%84%E3%83%8F%E3%82%A4%E3%83%9E%E3%83%BC%E5%9E%8B%E8%AA%8D%E7%9F%A5%E7%97%87)を読みますと、「家族性アルツハイマー病では、原因遺伝子としては4種類が知られており、21番染色体のアミロイド前駆体蛋白遺伝子、14番染色体のプレセニリン1遺伝子、1番染色体のプレセニリン2遺伝子、19番染色体のアポリポ蛋白E遺伝子のいずれかが変異を起こすと家族性アルツハイマー病が発症する。」と記載されております。
しかしながら専門的には、特定の遺伝子変異を持つことによりアルツハイマー病をほぼ100%発病する原因遺伝子によるものを家族性アルツハイマー病と呼んでおり、第21染色体上のアミロイド前駆体タンパク遺伝子(APP)、第14染色体上のプレセニリン1遺伝子(PS1)、第1染色体上のプレセニリン2遺伝子(PS2)の3つが原因遺伝子として知られています(認知症テキストブック 中外医学社, 東京, 2008, p234)。なお、家族性アルツハイマー病(遺伝性アルツハイマー病)は、基本的にはすべて早発型(60歳ないし65歳以前に発症)ですと先程述べておりますが、プレセニリン2遺伝子によるものは若干発症年齢が高いことも知られております(http://www.jfnm.or.jp/nl/news05/news5hp4-10.pdf)。プレセニリン2遺伝子によるものは頻度的には少なく、「Presenilin-1の変異では若年発症アルツハイマー病の30~70%、presenilin-2では5%以下で、APP変異は10~15%」(編集/朝田 隆 著/山田達夫:認知症診療の実践テクニック─患者・家族にどう向き合うか医学書院, 東京, 2011, pp3-4)といわれています。
シリーズ第81回『アルツハイマー病の予防 DHAが効く人もいるけど、別の問題も』のメモ2において述べましたように、アポリポ蛋白E4(遺伝子型はε4=イプシロン4)は、AD発症の危険性を高める感受性遺伝子であり、アルツハイマー病(AD)最大の危険因子と考えられていましたね。
少しだけ要点を復習しておきましょうね(山田達夫:認知症診療の実践テクニック─患者・家族にどう向き合うか医学書院, 東京, 2011, pp3-4)。
「singleε4ではε3/ε3を基準にした場合3.2倍、ε4/ε4では11.6倍発症率が高まるといわれる。しかし、ApoEは遺伝的素因の50%程度を説明しているにすぎず、それ以外の遺伝的危険因子の解析が進行している。」
50%ではなく、もっと少ないという意見もあります。新潟大学脳研究所附属生命科学リソース研究センター(http://www.bri.niigata-u.ac.jp/~idenshi/)遺伝子機能解析学の桑野良三教授らは、「孤立性ADの遺伝的リスクとしてApoEε4が民族を超えて認められています。しかし、ApoEε4遺伝型で説明できるのは20%程度とされ、残るリスク遺伝子の探索が精力的に行われています。」(温 雅楠、桑野良三:アルツハイマー病と遺伝. からだの科学通巻278号 8 2013)と報告しています。
Facebookコメント
Medical Tribuneの2013年8月15日号(Vol.46 No.33 p2)において、「ADの家族歴ある者で高い無症候性の脳内プラーク蓄積リスク─家族歴ない者と比べリスクが2倍以上」(http://mtpro.medical-tribune.co.jp/mtnews/2013/M46330022/)というニュースが伝えられました。極めて重要な報告でありますので、以下に抜粋してご紹介しましょう。
「デューク大学(ダーラム)精神医学・内科学のP. Murali Doraiswamy教授らは、第1度親族にアルツハイマー病(AD)患者がいると、こうした家族歴がない者と比べADに関連した無症候性の脳内プラーク蓄積リスクが2倍以上高まることが分かったとPLoS One(2013;8:e60747)に発表した。
家族歴は遅発性ADの危険因子と予測因子であることが既に知られており、第1度親族(父母・兄弟姉妹)にAD患者がいる場合の発症リスクは2~4倍になることが複数の研究で示唆されている。第1度親族間の遺伝子共有は約50%とされている。ADの遺伝因子のうち約50%は、APOE遺伝子型や一般的な遺伝的変異が占めているが、他の遺伝的原因はまだ解明されていない。
研究責任者のDoraiswamy教授は『今回の研究では、家族歴は陽性だが、それ以外は正常か軽度の物忘れがあるだけの人でも、無症候性のアミロイドプラーク蓄積が起こるかどうかを検討した』と述べている。
同教授と同大学神経科学部門の研究生であるErika J. Lampert博士らは、バイオマーカーを用いてAD進行の定義を検討している全米研究Alzheimer's Disease Neuroimaging Initiativeの一環として、さまざまなレベルの認知機能障害患者と認知機能正常者を含む成人257例(55〜89歳)のデータを分析。年齢、性、AD家族歴などのデータを収集した。家族歴陽性は、親か兄弟姉妹のいずれかにAD患者がいる者と定義した。次に、こうした情報を、認知機能評価やAPOE遺伝子型解析、MRIによる海馬容積の測定、脳脊髄液中の3種類の病理学的マーカー〔アミロイドβ(Aβ)42、総タウ蛋白(t-tau)、t-tau/Aβ42比〕などの生物学的検査結果と照合した。
家族歴のある者では、予想通りADリスクと早期発症リスクの上昇に関連するAPOE遺伝子の発現が亢進していた。さらに、家族歴のある者では、家族歴のない者との生物学的な差が他にも見られたことから、まだ発見されていない遺伝的因子が認知症発症前のAD進行に影響を与えている可能性が示唆された。家族歴陽性の健康人の約半数は、脳脊髄液測定に基づく前臨床的ADの基準を満たしたが、家族歴のない者でこの基準を満たしたのは約20%のみだった。」
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第227回『親がアルツハイマー病、私の将来はどうかな!─危険因子の有無を調べても……』(2013年8月14日公開)
プレセニリン1(presenilin 1;PS1)といった家族性アルツハイマー病の原因遺伝子ではないものの、危険因子(アポリポ蛋白E4)の有無を調べて欲しいと希望される方は、私の外来にもちょくちょく来られます。
シリーズ第12回『認知症の診断─もの忘れ検診』において、私が1996年7月9日に国内で初めて開設した「認知症の検診」についてご紹介しましたね(笠間 睦:痴ほう専門ドックの開設. 脳神経 Vol.49 195 1997)。この「痴ほう専門ドック」において実施していた検査項目の1つには、実はアポリポ蛋白E4の採血検査も含まれておりました。
しかし今は、「アポリポ蛋白E4の保有が分かっても、今のところ治療法がないこと」をきちんと説明し検査は実施しておりません。
現在においても、アポリポ蛋白Eのフェノタイプ(http://www.sms.co.jp/reference/detail.php?PHPSESSID=1b39391eb0cd02366cc6e6f6ce9868cf&pos=28&s=1532&PHPSESSID=1b39391eb0cd02366cc6e6f6ce9868cf)を調べているいる医療機関は多数あります。しかしながらその目的は、家族性脂質異常症の精査目的(http://www.mh.nagasaki-u.ac.jp/kensa/news/225.pdf)であり、アルツハイマー病の危険因子をチェックする目的で実施されているわけではありません。
ApoEには主にE2、E3、E4の3つの表現型があり、E2/E2はLDL受容体への結合能が著しく低下しておりⅢ型家族性脂質異常症を呈する可能性があります(蔵野 信、木下 誠:アポリポ蛋白とリポ蛋白分画. medicina Vol.50 978-981 2013)。Ⅲ型家族性脂質異常症については、ウィキペディア(http://ja.wikipedia.org/wiki/%E8%84%82%E8%B3%AA%E7%95%B0%E5%B8%B8%E7%97%87)などをご参照下さい。
日本医学会が2011年2月に発表した「医療における遺伝学的検査・診断に関するガイドライン」(http://jams.med.or.jp/guideline/genetics-diagnosis.pdf)においては、「被検者の診断結果が血縁者の健康管理に役立ち、その情報なしには有効な予防や治療に結びつけることができないと考えられる場合には、血縁者等に開示することも考慮される。その際、被検者本人の同意を得たのちに血縁者等に開示することが原則である。例外的に、被検者の同意が得られない状況下であっても血縁者の不利益を防止する観点から血縁者等への結果開示を考慮する場合がありうる。この場合の血縁者等への開示については、担当する医師の単独の判断ではなく、当該医療機関の倫理委員会に諮るなどの対応が必要である。」と規定されており、個人の遺伝情報の開示にあたっては各医療機関の倫理委員会などでの協議も必要となります。
2013年6月14日号の週刊ポスト(通巻2233号)では、「医療最前線─ここまでわかった・ボケる遺伝子」という特集が組まれましたね。タイトル誘われついつい買ってしまいました。不安を煽るだけではなく、きちんと情報開示のことに踏み込んで記載しておりました。その部分を以下にご紹介しましょう。
「アポE4とアルツハイマー病の発症リスクの相関関係は強い。そのため、検査結果の告知には、十分な配慮がなされている。多くの病院や検査機関では、検査対象者にその結果を知る重要性をきちんと伝え、同意が得られた場合のみ結果を示す。」(週刊ポスト通巻第2233号, 142-146, 2013)
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第228回『親がアルツハイマー病、私の将来はどうかな!─予防的治療薬を与える大規模な研究』(2013年8月15日公開)
アルツハイマー病の原因遺伝子を保有するキャリアに対して、未発症の段階から早期介入または予防的治療薬投与を試みる大規模な研究が進められており、東北大学加齢医学研究所老年医学分野の荒井啓行教授がその概略について言及しております(岩坪 威、荒井啓行、井原康夫:座談会─アルツハイマー病. Current Therapy Vol.30 360-368 2012)。その概要と今後の展望についてご紹介し本稿を閉じたいと思います。
「Alzheimer's Prevention Initiative(API)による臨床研究は、南米のコロンビアにあるアンティオキアという町を舞台にした介入研究の計画です。そこに、あるファウンダー(創始者)から発したと思われるPS-1遺伝子変異の非常に大きな家系があります。その家系の現存者1,235名のうち、480名がミューテーション(変異)をもちながら、まだ発症していないキャリアであり、ミューテーション陽性者の平均発症年齢は48歳であることがわかっています。このキャリアの方を対象に、おそらく20代、30代あたりから、疾患修飾薬による治療を脳脊髄液のAβやアミロイドPETなどのバイオマーカーを用いて追跡しながら行うのです。つまり、アミロイドの蓄積を一度リセットし、アミロイドの全くない脳に戻したときに、はたして発症年齢をどれだけ遅らせることができるかを検討する壮大な研究計画です。」(一部改変)
筑波大学臨床医学系精神医学の朝田隆教授はこの研究について、「Alzheimer's Prevention Initiativeによる臨床研究では、ADを早期に発症する希少な遺伝子変異をもつ大家族で、Genentech社による治療薬crenezumabの効果が試されています。ここでは300名の未発症に人において、従来は避けられなかった認知機能低下に歯止めをかけられるか否か、また発症を遅くすることができるか否かが、5年間の追跡調査により調べられます(Miller G:Alzheimer's research. Stopping Alzheimer's before it starts. Science Vol.337 790-792 2012)。」(朝田 隆:アルツハイマー病の発症予防法の開発. からだの科学通巻278号 161-165 2013)と述べております。
そして、APIの他にも、DIAN(Dominantly Inherited Alzheimer Network)、A4(Anti-Amyloid Treatment in Asymptomatic AD Trial)といった研究組織が有望な検討を模索しております(http://211.144.68.84:9998/91keshi/Public/File/41/337-6096/pdf/790.full.pdf)。
DIANは、既知3タイプのAD原因遺伝子によって生じる早発性ADを研究するために2008年に設立された組織です。
なお、A4の研究対象は、70歳以上でPETによるアミロイドイメージングにて陽性であるが認知機能は正常な人(preclinical AD)であり、Aβを減少させることにより後続する神経細胞死へと至る流れに歯止めをかけられるか否かを検証することを主目的としており、DIANとは異なり、遺伝性ではない弧発性のアルツハイマー病の病理進行に注目して治療介入を目指すものです。
なお、A4研究(http://www.alzforum.org/new/detail.asp?id=3379)におきましては、シリーズ第189回『アルツハイマー病を治す薬への道─アルツハイマー病は3型糖尿病』のコメント欄およびシリーズ第95回『アルツハイマー病の治療薬─アルツハイマー病根本治療薬の姿』においてご紹介しましたsolanezumab(ソラネズマブ)の効果が試されます。
Facebookコメント
「米国は、『2025年までに効果的な予防と治療法の開発を達成する』と国家的に取り組むことを明確に打ち出した。NIA(National Institute for Aging)が主導して、ADGCとADNIが受け皿となってADSP(Alzheimer's Disease Sequencing Project=https://www.niagads.org/adsp)が進行している。家族性AD100家系以上を対象とした全ゲノムシークエンス並びにAD5,000人とその対照群5,000人の全エクソーム解析が、2013年3月に開始され2015年12月に終了する。これらのプロジェクトは、研究成果を共有して効率的な解析を推進すること基本としている。日本も先導的にこれらの国際共同研究に早く参加しなければ、またしても後手にまわり、単に日本人のデータを提供する隷属研究に陥るであろう。」(桑野良三、月江珠緒:アルツハイマー病診断における遺伝子・バイオマーカーの意義. Dementia Japan Vol.27 334-343 2013)
Facebookコメント
A4研究:
「抗アミロイド抗体による加療により、3年後にバイオマーカーにどのような変化が生じるかを検討するのがA4研究である。すなわち上流にあるアミロイド蓄積を抗体療法によって減らすことにより、下流にある神経細胞死や認知機能低下を予防できないか検討する試験である。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
Facebookコメント
「APIは、南米コロンビアに住む地域住民に多く認められるPSEN1遺伝子にE280A変異を有する早発型家族性アルツハイマー病(early onset familial Alzheimer disease;EOFAD)患者を対象にAβ抗体であるcrenezumabによる抗体療法の効果を検証する試験である。
本家系は25年以上前にコロンビアのアンティオキア大学のLoperaらにより発見されたもので、現在5,000人以上が北コロンビアの山岳地帯に住んでいる。本家系の症状の特徴は早発であるということを除けば、記憶障害で発症することなど、全体的な症状は孤発性のアルツハイマー病とよく似ている。平均発症年齢は47歳である。本家系の多くのキャリアは30代前半で、他に症状がなくても記憶障害を捉えることができるという。本研究では認知機能検査で異常がないと確認された30歳以上のキャリアが試験にリクルートされる。本家系では30歳以上のキャリアなら、既に脳内にはアミロイドの沈着が認められる。
昨年末、本家系の中で未発症である18~26歳の20人においてDIAN研究と同様のバイオマーカーの比較研究を行った結果が発表された(文献20, 21)。その結果、髄液のAβ42はDIAN研究と同様に、遺伝子変異を有するキャリアにおいて当初有意な上昇が認められた。頭部MRIでは既に頭頂部および頭頂側頭部の灰白質に萎縮が認められ、fMRIでは海馬の活性化と両側の後部帯状回の非活性化が認められた(文献20)。
また、同時に発表されたアミロイドPET研究では、20~56歳を対象として、遺伝子変異を有するキャリア11人(認知症4人、MCI7人)、未発症キャリア19人、非キャリア20人のアミロイド蓄積量を比較している。その結果、非キャリア群に比べ、未発症キャリア群は有意に蓄積量が多いことが認められた。さらに、3群のデータから、アミロイド蓄積量が発症前から経年的に増加し、プラトーに達した後MCI、認知症へと進行していくことが示された(文献21)。」(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)
参考文献:
20)Reiman EM,Quiroz YT,Fleisher AS et al:Brain imaging and fluid biomarker analysis in young aduls at genetic risk for autosomal dominant Alzheimer's disease in the presenilin 1 E280A kindred: a case-control study. Lancet Neurol Vol.11 1048-1056 2012
21)Fleisher AS,Chen K,Quiroz YT et al:Florbetapir PET analysis of amyloid-beta deposition in the presenilin 1 E280A autosomal dominant Alzheimer's disease kindred: a cross-sectional study. Lancet Neurol Vol.11 1057-1065 2012
Facebookコメント
DIAN(Dominantly Inherited Alzheimer Network)研究の詳細について記述した論文(嶋田裕之:DIAN研究. BRAIN and NERVE Vol.65 1179-1184 2013)をシリーズ第94回『アルツハイマー病の治療薬 アルツハイマー病が発症する前に診断される状態がある』(http://apital.asahi.com/article/kasama/2013032800005.html)のコメント欄において紹介しておりますのでご参照下さい。
Facebookコメント
「遺伝的な要因で発症する『家族性アルツハイマー病』の人たちが国内にどれだけいるか、実態調査を厚生労働省の研究チームが2013年11月から始める。結果をもとにまだ症状のない家族性の人に薬を使って発症を防ぐ試みにつなげたい考えだ。」
DLBのSPECT所見を読影する際の注意点 [レビー小体型認知症]

語り 021
床を虫がつっつっつーと歩いているのを見て、「あれ、こんなところに虫がいる」って思いました。数秒間なんですけれども、虫が歩いてぱっと止まったときに、それが綿くずだったんですね。それを見たときに、「これは目の錯覚でも何でもない。これこそが幻視なんだ」と思いました。そのとき、ほんとに血の気が引くというか、……冷汗は出ませんでしたけれども、とんでもないことになったと思いました。
で、病院に行かなければいけないと思いました。ただ、誤診が多いということなので、誤診されたらたまらないと思いまして、調べました。で、この先生なら大丈夫だろう、というところに、かなり遠かったんですけれども、行きました。
そこで、脳血流の検査、MRIとMGBI〔MIBGのこと〕だったっけ、心筋シンチグラフィの検査をしまして、あと、血の検査とか、血圧の検査とかしました。で、結局、画像には出ませんでした。MRI正常。ま、レビーではそれが当たり前なんですけれども。で、脳血流は、レビーでは後頭葉が血流低化すると言うんですけれども、私の場合は前頭葉が血流低下しているって。「これは、うつ病でよくあるものです」って言われました。心筋シンチグラフィは9割の精度でわかるということなんですけども、……レビーは心臓が(黒く)写らないんですけども、私は写ったんですね〔p.60参照〕。
知能検査は、計算を全部間違いました。100引く7っていうやつですね。100引く7、はい、また7引いて、7引いてって、それを私は全部間違えたようで……。自分ではわからなかったんですけども、「認知機能の低下があります」と言われました。「何を間違ったんですか」って聞きましたら、「計算が違っていました」って。
で、「画像で出ないので、診断できません。診断できませんから、治療もできません」と言われました。
早期発見・早期治療が、残された唯一の希望だと思っていましたので、「治療しない」と言われて、……何か、こう、命綱が目の前で、ぷつんと切られたと感じまして、……ほんとに、私の真後ろに死神が立っていて、今にも鎌を振り下ろしそうなので、「何とかしてください」って言いに行ったのに、「鎌を振り下ろして、けがをしたら来てください」って言われたような……、そういう感じがしましたね。
本人11(プロフィール:p.613)
【認知症の語り─本人と家族による200のエピソード. 健康と病いの語りディペックス・ジャパン, 東京, 2016, pp57-59】
私の感想:
福井俊哉先生が著書『症例から学ぶ戦略的認知症診断』の中で、DLBのSPECT所見を読影する際の注意点について言及しております。
たいへん重要な視点を述べておられますので以下に抜粋してご紹介致します。
DLBの診断基準の支持的症状の一つとして,「SPECT上の後頭葉の機能低下を伴った全体的な取り込み低下」がある.これはあくまでも,DLBとADを比較した場合の所見であることに注意を要する.DLBをADと比較した場合には,後頭葉[Lobotesisら2001,Pasquierら2002,Rossiら2009]または頭頂後頭葉[Collobyら2002]における取り込み低下がDLBにてより高度である.しかし,この点が強調され過ぎ,後頭葉取り込み低下を示さない症例はDLBにあらずといった極論すら見聞するが,これは大きな誤解である.後頭葉取り込み低下所見のDLBとADの鑑別診断に対する感度は60~70%[Lobotesisら2001,Pasquierら2002],特異度は87%[Lobotesisら2001]程度である.さらに後頭葉における取り込み低下を呈するDLB症例は7割弱[Tatenoら2008]に過ぎない.一方,DLBやPDDを正常コントロールと比べた場合は,後頭葉には有意な取り込み低下は見られず,頭頂後頭葉,頭頂葉,前頭葉,視床などが主たる取り込み低下部位である[Rossiら2009,Changら2008].側頭葉の取り込みはPDよりもDLBで有意に低値である[Changら2008].したがって,健常人を正常コントロールとするSPECT統計ソフト(easy Z-score Imaging System(eZIS),Voxel-Based Stereotactic Extraction Estimation(vBSEE)をDLB症例に応用する場合には,後頭葉ではなく,頭頂後頭葉,前頭葉,側頭葉にて取り込み低下が見られることがDLBの特徴であることを念頭に置くべきである.後頭葉取り込み低下はDLB診断基準の支持的症状ではあるが,その意味合いは「DLBとADの鑑別上重要な所見である」というもので,DLBを正常対象や非AD認知症疾患と対比した場合の所見ではないことに注意を喚起したい.
…(中略)…
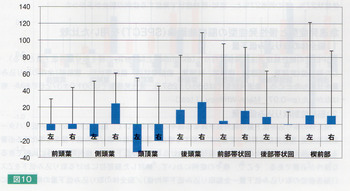
図10はDLB19例全例における,検討脳部位における取り込み変化を示したものである.Y軸はこのextensionとseverityの積であるが,マイナス方向は取り込み低下,プラス方向は相対的な取り込み増加を示す.相対的な取り込み増加とは,当該脳部位の取り込み低下が全脳の取り込み低下の平均値よりも軽度であることを意味し,必ずしも実際に取り込みが亢進していることを示すのではない.
取り込み低下は主に前頭葉と頭頂葉にてみられた.後頭葉ではむしろ相対的な取り込み増加が見られた.これは,DLBを正常コントロールと比較した場合,前頭葉,頭頂葉,前部帯状回,楔前部の取り込み低下が重要であるとの見解[Rossiら2009,Changら2008]を支持するものであった.この結果から,正常例を対照とするeZIS/VbSEE処理のSPECT所見を用いてDLB診断を行う際,後頭葉に単独の取り込み低下を認めなくてもDLBは必ずしも否定できないことが理解できよう.
【福井俊哉:症例から学ぶ戦略的認知症診断 南山堂発行, 東京, 2011, pp234-238】
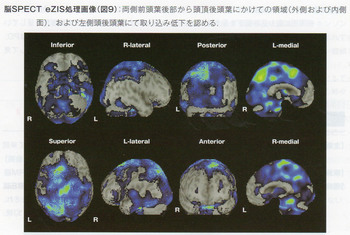
本例のように,CDT(Clock Drawing Test)などの視空間認知課題の障害が全般性認知レベルに比べて不釣り合いに高度であることがDLBの診断に結びつくことが少なくない.SPECTを用いてCDT障害と高度・軽度DLBの関係を比較した検討[Nagahamaら2008]によると,CDT高度障害DLBにおいて両側前頭葉眼球運動領域,補足運動野,被殻,視床の取り込みが有意に低かった.したがって,DLBでは前頭葉線条体障害が視空間認知に関わる注意/覚醒障害を生じる結果,視空間認知障害が顕著になると推測されている[Nagahamaら2008].
【福井俊哉:症例から学ぶ戦略的認知症診断 南山堂発行, 東京, 2011, p229-234】
P.S.
[Nagahamaら2008]
Nagahama Y, et al.:Cerebral substrates related to impaired performance in the clock-drawing test in dementia with Lewy bodies. Dement Geriatr Cogn Disord, 25:524-530 2008.
Abstractは以下サイトにてお読み頂けます。
http://www.ncbi.nlm.nih.gov/pubmed/18477845
改訂長谷川式認知症スクリーニングテスト(HDS-R) [アルツハイマー病]
語り 014

心療内科のある市立病院に行って、MRIとか脳波とかの検査をして、若年性アルツハイマーだと言われました。海馬〔脳の大脳辺縁系の一部〕の萎縮が見られるって。そのときは、「中期ぐらいです」って言われたんですが、私たちも受け止めることができなくって。「うそだろう」というところもあり、若年性アルツハイマー専門の外来があることを友だちから聞いて、そこでセカンドオピニオン的な形で診ていただいたら、「初期」って言われました。
長谷川式っていう筆記のテストの点数が、テストをしたのは2か月しか違わないのに、結果が全然違っていて、市立病院では16点だったんですが、専門外来では23点だったんですよ。市立病院は先生が外来の患者を診るお部屋の中の、ワサワサした環境の中で、時計とか見せながらやっていたんですけど、専門外来ではちゃんとしたお部屋があって、こぎれいでゆっくりした環境の中でやらしてもらえるんです。だからそういう環境の違いで、病院の診断も違うんだなって、すごくわかりました。
市立病院だと、家族の気持ちを聞く余裕がないんですよ。問診して、お薬をくれるだけでいっぱいいっぱい。専門外来では最初は20分ぐらい話を聞いてくれる。なので、今は2つの病院を使い分けています。
介護者03(プロフィール:p.599)
【認知症の語り─本人と家族による200のエピソード. 健康と病いの語りディペックス・ジャパン, 東京, 2016, pp39-40】
私の感想:
よくあるパターンですね。
でも、「中期」と言われたり、「初期」と言われたら、戸惑ってしまいますよね。
アピタルより、関連事項を以下に記載いたします。
第13回の中で私は「私自身の経験では、初期アルツハイマー病の患者さんで初回のHDS-Rが27点であった方を経験しております。」と述べておりますが、最近では、HDS-R満点の初期アルツハイマー病の方も数多く経験しております。
ですから、本当の「初期」診断には、改訂長谷川式認知症スクリーニングテスト(HDS-R)では「限界」があることを知っておくべきです。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第13回『認知症の診断─認知機能の検査』(2012年12月27日公開)
簡便に認知機能や記憶力を測定できる認知機能検査として、日本国内ではMMSE(Mini-Mental State Examination)と改訂長谷川式認知症スクリーニングテスト(HDS-R)が普及しております。
近年は、HDS-RよりもMMSEが多用される傾向にあります。しかしHDS-Rの方が、1)記憶を重視し、2)被験者の負担が少なく、3)教育歴の影響を受けにくいので、日常臨床ではMMSEよりもHDS-Rの方が有用という意見もあります(山口晴保:認知症の正しい理解と包括的医療・ケアのポイント 協同医書出版社, 東京, 2010, p225)。
認知機能検査の数値に関しては、今後このブログで何度も紹介する指標になると思いますので、この機会に説明しておきます。
改訂長谷川式認知症スクリーニングテスト(HDS-R)は、認知症のスクリーニングテストとしてわが国で開発されたもので30点満点です。
実際にHDS-Rを行ってみましょう。
その前に、HDS-R実施にあたっての注意事項を、詳しく解説しているサイト(http://ninchisyoucareplus.com/plus/pdf/070421%E5%8A%A0%E8%97%A4%E6%8A%84%E9%8C%B2.pdf)がありますので、このサイトを開いて検査用紙(p13)をプリントアウトして下さい。
質問は全部で9項目あります。
1. 年齢(記憶)
2. 時間の見当識
3. 場所の見当識
4. 3単語の即時再生(記銘)
5. 引き算(計算力と注意力)
6. 数字の逆唱(記憶と注意力)
7. 3単語の遅延再生(想起)
8. 5物品想起
9. 野菜の名前(言語の流暢性)
質問1の年齢に関する質問に関しては、2年までの誤差は正解とします。
実はこの質問だけでも、アルツハイマー病かな?と疑わせるような回答内容があります。それは、例えば「大正13年生まれやから、何歳なのか先生考えたら分かるでしょう」というような回答をした場合です。自分の年齢は忘れてしまっても、生年月日は何度も繰り返し刻み込まれた記憶ですので覚えており、その場を取り繕うため、上記のような返事をするのです。
さてHDS-Rの結果判定に際して、鍵を握る設問の一つが質問7です。
質問4で覚えてもらった三つの言葉を、もう一度言ってもらうものです。これは遅延再生(Delayed Recall)の障害をチェックするものです。アルツハイマー病患者さんでは遅延再生が顕著に障害されますので、他の設問に正答してもこの設問だけが回答できないというケースも多く、初期のアルツハイマー病を見逃さないために最も注目すべき項目です。
質問8の実施にあたっては、事前に相互に関係のない5つの物品を用意し隠しておく必要があります。例えば、以下のものをご用意下さい。
時計 歯ブラシ スプーン 鍵 鉛筆
質問9は、「知っている野菜の名前をできるだけ多く言って下さい。」という設問です。いくつ言えましたか? 採点上の注意点として、野菜の名前が重複した場合は、採点に加えません。途中で詰り約10秒待っても出ない場合はそこでテストは終了します。採点は5個までは0点で、以後6個=1点、7個=2点、8個=3点、9個=4点、10個=5点となります。この設問は、「言葉の流暢性」をチェックしております。
前頭葉の機能が低下してくると、野菜の名前がスラスラと出てこなくなります。
HDS-Rは30点満点であり、20点以下は「認知症の疑い」と判定されます。
では21点以上獲得できれば認知症の心配はないのでしょうか? 私自身の経験では、初期アルツハイマー病の患者さんで初回のHDS-Rが27点であった方を経験しております。検査の点数には教育歴(学校等で学んだ年数)なども影響しますので、21/20点というラインで杓子定規に判定することはできないのです。
また逆に、20点以下ならば安易に「認知症の疑い」と判断することも慎む必要があります。八千代病院(愛知県安城市)神経内科部長の川畑信也医師は、「著者が開設している『物忘れ外来』で健常者と診断された161人のHDS-Rの得点分布をみると、30歳代から50歳代までの年齢層では全員が21点以上を獲得しているが、60歳代では10.0%、認知症の好発年齢となる70歳代では16.3%、80歳代では14.3%が20点以下であった。」(一部改変)と報告し(川畑信也:物忘れ外来ハンドブック─アルツハイマー病の診断・治療・介護─ 中外医学社, 東京, 2006, pp70-73)、HDS-Rの結果を解釈する際に留意すべき点であると指摘しています。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第14回『認知症の診断─素人判断は難しい』(2012年12月28日公開)
素人判断は、難しいわけですね?
はい! 確かに、素人判断は危険です!!
ですから、物忘れが気になるおじいちゃん・おばあちゃんに対してテストを実施してみることは構いませんが、あくまでも一つの目安として捉えて下さいね。
医療機関においては、認知症が疑わしい状況であるならば、認知機能検査を1回きりで終わらせるのではなく、時間を置いて再検査します。
それは、アルツハイマー病では、HDS-Rが年間2.5点悪化し、MMSEでは病期全期間で年間に2.2点(ただし、軽度~中等度の時期では、年間3.4点)悪化していくことが知られているからです。進行の有無をきちんと確認することは、アルツハイマー病であるかどうか正しく判定する上で欠かせません。
得点による重症度分類は行わない(http://ninchisyoucareplus.com/plus/pdf/070421%E5%8A%A0%E8%97%A4%E6%8A%84%E9%8C%B2.pdf)ことになっております。しかしながら、各重症度別のHDS-R平均得点の目安も報告されています。
非認知症: 24.27±3.91
軽度 : 19.10±5.04
中等度 : 15.43±3.68
やや高度: 10.73±5.40
非常に高度: 4.04±2.62
大まかな目安として、中等度の認知機能低下(HDS-R≧16点)、やや高度の認知機能低下(15≧HDS-R>10点)、高度の認知機能低下(10点≧HDS-R)と覚えておいて下さい。
なお、認知機能検査が何点以下なら「意思能力の欠如」という明確な規定を定めることは困難です。それは、検査の点数には教育歴などが影響しますし、問題となる法律行為(意思表示)の内容によって、必要とされる意思能力は異なるという背景があるからです。
MMSEは30点満点の認知機能検査で、目安として、9点以下は高度アルツハイマー病、10~19点が中等度アルツハイマー病、20~23点が軽度(初期)アルツハイマー病、24点以上は軽度認知障害(MCI)ないし正常と判定されます。
すなわち、30点満点を獲得してもMCIと評価される場合もあり得るということになります。
リバーミード行動記憶検査(日本版/RBMT)は、国際的にも評価の高い記憶障害の判定・診断のための検査です。
特徴は、単語を覚えるなどの机上のテストではなく、日常生活をシミュレーションして、記憶を使っている場面場面を想定して検査することです。
RBMTには、標準プロフィール点とスクリーニング点という2つの指標があり、検査の所要時間は約30分です。
標準プロフィール点(24点満点、22点以上は正常)は、日常生活上の行動の把握や治療効果などを評価できます。数点しか獲得できない場合には新しい情報の学習はかなり困難であり、病棟内では迷子となる危険性があります。訓練スケジュールを記憶しているレベルは、10点以上とされています。
スクリーニング点(12点満点)は、全般的な記憶機能の指標となります。
アルツハイマー病の前段階とされる軽度認知障害(Mild Cognitive Impairment;MCI)では、標準プロフィール点が15点以下、スクリーニング点が5点以下となることが多いです。
アルツハイマー病では、標準プロフィール点が5点以下、スクリーニング点が1点以下まで低下してきます。
私の検討した結果では、HDS-Rが26点辺りまで低下してきますと、RBMTが基準点以下に低下していることが多く、「初期アルツハイマー病」と診断される可能性が出てきます。
認知症が専門ではない医師の場合には、HDS-Rが26点も獲得できればそれだけで「異常なし」と判断してしまい、精密検査を実施しないことも多いですので診断医の力量には留意する必要があります。
Facebookコメント
MMSE(http://ja.wikipedia.org/wiki/%E3%83%9F%E3%83%8B%E3%83%A1%E3%83%B3%E3%82%BF%E3%83%AB%E3%82%B9%E3%83%86%E3%83%BC%E3%83%88%E6%A4%9C%E6%9F%BB)における3単語(「桜」・「猫」・「電車」)の想起について:
「直後再生は主に注意課題、遅延再生は記憶課題である。」(吉益晴夫:神経心理学的検査. 日本医師会雑誌・生涯教育シリーズ85 神経・精神疾患診療マニュアル Vol.142・特別号(2) S58-59 2013)

心療内科のある市立病院に行って、MRIとか脳波とかの検査をして、若年性アルツハイマーだと言われました。海馬〔脳の大脳辺縁系の一部〕の萎縮が見られるって。そのときは、「中期ぐらいです」って言われたんですが、私たちも受け止めることができなくって。「うそだろう」というところもあり、若年性アルツハイマー専門の外来があることを友だちから聞いて、そこでセカンドオピニオン的な形で診ていただいたら、「初期」って言われました。
長谷川式っていう筆記のテストの点数が、テストをしたのは2か月しか違わないのに、結果が全然違っていて、市立病院では16点だったんですが、専門外来では23点だったんですよ。市立病院は先生が外来の患者を診るお部屋の中の、ワサワサした環境の中で、時計とか見せながらやっていたんですけど、専門外来ではちゃんとしたお部屋があって、こぎれいでゆっくりした環境の中でやらしてもらえるんです。だからそういう環境の違いで、病院の診断も違うんだなって、すごくわかりました。
市立病院だと、家族の気持ちを聞く余裕がないんですよ。問診して、お薬をくれるだけでいっぱいいっぱい。専門外来では最初は20分ぐらい話を聞いてくれる。なので、今は2つの病院を使い分けています。
介護者03(プロフィール:p.599)
【認知症の語り─本人と家族による200のエピソード. 健康と病いの語りディペックス・ジャパン, 東京, 2016, pp39-40】
私の感想:
よくあるパターンですね。
でも、「中期」と言われたり、「初期」と言われたら、戸惑ってしまいますよね。
アピタルより、関連事項を以下に記載いたします。
第13回の中で私は「私自身の経験では、初期アルツハイマー病の患者さんで初回のHDS-Rが27点であった方を経験しております。」と述べておりますが、最近では、HDS-R満点の初期アルツハイマー病の方も数多く経験しております。
ですから、本当の「初期」診断には、改訂長谷川式認知症スクリーニングテスト(HDS-R)では「限界」があることを知っておくべきです。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第13回『認知症の診断─認知機能の検査』(2012年12月27日公開)
簡便に認知機能や記憶力を測定できる認知機能検査として、日本国内ではMMSE(Mini-Mental State Examination)と改訂長谷川式認知症スクリーニングテスト(HDS-R)が普及しております。
近年は、HDS-RよりもMMSEが多用される傾向にあります。しかしHDS-Rの方が、1)記憶を重視し、2)被験者の負担が少なく、3)教育歴の影響を受けにくいので、日常臨床ではMMSEよりもHDS-Rの方が有用という意見もあります(山口晴保:認知症の正しい理解と包括的医療・ケアのポイント 協同医書出版社, 東京, 2010, p225)。
認知機能検査の数値に関しては、今後このブログで何度も紹介する指標になると思いますので、この機会に説明しておきます。
改訂長谷川式認知症スクリーニングテスト(HDS-R)は、認知症のスクリーニングテストとしてわが国で開発されたもので30点満点です。
実際にHDS-Rを行ってみましょう。
その前に、HDS-R実施にあたっての注意事項を、詳しく解説しているサイト(http://ninchisyoucareplus.com/plus/pdf/070421%E5%8A%A0%E8%97%A4%E6%8A%84%E9%8C%B2.pdf)がありますので、このサイトを開いて検査用紙(p13)をプリントアウトして下さい。
質問は全部で9項目あります。
1. 年齢(記憶)
2. 時間の見当識
3. 場所の見当識
4. 3単語の即時再生(記銘)
5. 引き算(計算力と注意力)
6. 数字の逆唱(記憶と注意力)
7. 3単語の遅延再生(想起)
8. 5物品想起
9. 野菜の名前(言語の流暢性)
質問1の年齢に関する質問に関しては、2年までの誤差は正解とします。
実はこの質問だけでも、アルツハイマー病かな?と疑わせるような回答内容があります。それは、例えば「大正13年生まれやから、何歳なのか先生考えたら分かるでしょう」というような回答をした場合です。自分の年齢は忘れてしまっても、生年月日は何度も繰り返し刻み込まれた記憶ですので覚えており、その場を取り繕うため、上記のような返事をするのです。
さてHDS-Rの結果判定に際して、鍵を握る設問の一つが質問7です。
質問4で覚えてもらった三つの言葉を、もう一度言ってもらうものです。これは遅延再生(Delayed Recall)の障害をチェックするものです。アルツハイマー病患者さんでは遅延再生が顕著に障害されますので、他の設問に正答してもこの設問だけが回答できないというケースも多く、初期のアルツハイマー病を見逃さないために最も注目すべき項目です。
質問8の実施にあたっては、事前に相互に関係のない5つの物品を用意し隠しておく必要があります。例えば、以下のものをご用意下さい。
時計 歯ブラシ スプーン 鍵 鉛筆
質問9は、「知っている野菜の名前をできるだけ多く言って下さい。」という設問です。いくつ言えましたか? 採点上の注意点として、野菜の名前が重複した場合は、採点に加えません。途中で詰り約10秒待っても出ない場合はそこでテストは終了します。採点は5個までは0点で、以後6個=1点、7個=2点、8個=3点、9個=4点、10個=5点となります。この設問は、「言葉の流暢性」をチェックしております。
前頭葉の機能が低下してくると、野菜の名前がスラスラと出てこなくなります。
HDS-Rは30点満点であり、20点以下は「認知症の疑い」と判定されます。
では21点以上獲得できれば認知症の心配はないのでしょうか? 私自身の経験では、初期アルツハイマー病の患者さんで初回のHDS-Rが27点であった方を経験しております。検査の点数には教育歴(学校等で学んだ年数)なども影響しますので、21/20点というラインで杓子定規に判定することはできないのです。
また逆に、20点以下ならば安易に「認知症の疑い」と判断することも慎む必要があります。八千代病院(愛知県安城市)神経内科部長の川畑信也医師は、「著者が開設している『物忘れ外来』で健常者と診断された161人のHDS-Rの得点分布をみると、30歳代から50歳代までの年齢層では全員が21点以上を獲得しているが、60歳代では10.0%、認知症の好発年齢となる70歳代では16.3%、80歳代では14.3%が20点以下であった。」(一部改変)と報告し(川畑信也:物忘れ外来ハンドブック─アルツハイマー病の診断・治療・介護─ 中外医学社, 東京, 2006, pp70-73)、HDS-Rの結果を解釈する際に留意すべき点であると指摘しています。
朝日新聞アピタル「ひょっとして認知症-PartⅡ」第14回『認知症の診断─素人判断は難しい』(2012年12月28日公開)
素人判断は、難しいわけですね?
はい! 確かに、素人判断は危険です!!
ですから、物忘れが気になるおじいちゃん・おばあちゃんに対してテストを実施してみることは構いませんが、あくまでも一つの目安として捉えて下さいね。
医療機関においては、認知症が疑わしい状況であるならば、認知機能検査を1回きりで終わらせるのではなく、時間を置いて再検査します。
それは、アルツハイマー病では、HDS-Rが年間2.5点悪化し、MMSEでは病期全期間で年間に2.2点(ただし、軽度~中等度の時期では、年間3.4点)悪化していくことが知られているからです。進行の有無をきちんと確認することは、アルツハイマー病であるかどうか正しく判定する上で欠かせません。
得点による重症度分類は行わない(http://ninchisyoucareplus.com/plus/pdf/070421%E5%8A%A0%E8%97%A4%E6%8A%84%E9%8C%B2.pdf)ことになっております。しかしながら、各重症度別のHDS-R平均得点の目安も報告されています。
非認知症: 24.27±3.91
軽度 : 19.10±5.04
中等度 : 15.43±3.68
やや高度: 10.73±5.40
非常に高度: 4.04±2.62
大まかな目安として、中等度の認知機能低下(HDS-R≧16点)、やや高度の認知機能低下(15≧HDS-R>10点)、高度の認知機能低下(10点≧HDS-R)と覚えておいて下さい。
なお、認知機能検査が何点以下なら「意思能力の欠如」という明確な規定を定めることは困難です。それは、検査の点数には教育歴などが影響しますし、問題となる法律行為(意思表示)の内容によって、必要とされる意思能力は異なるという背景があるからです。
MMSEは30点満点の認知機能検査で、目安として、9点以下は高度アルツハイマー病、10~19点が中等度アルツハイマー病、20~23点が軽度(初期)アルツハイマー病、24点以上は軽度認知障害(MCI)ないし正常と判定されます。
すなわち、30点満点を獲得してもMCIと評価される場合もあり得るということになります。
リバーミード行動記憶検査(日本版/RBMT)は、国際的にも評価の高い記憶障害の判定・診断のための検査です。
特徴は、単語を覚えるなどの机上のテストではなく、日常生活をシミュレーションして、記憶を使っている場面場面を想定して検査することです。
RBMTには、標準プロフィール点とスクリーニング点という2つの指標があり、検査の所要時間は約30分です。
標準プロフィール点(24点満点、22点以上は正常)は、日常生活上の行動の把握や治療効果などを評価できます。数点しか獲得できない場合には新しい情報の学習はかなり困難であり、病棟内では迷子となる危険性があります。訓練スケジュールを記憶しているレベルは、10点以上とされています。
スクリーニング点(12点満点)は、全般的な記憶機能の指標となります。
アルツハイマー病の前段階とされる軽度認知障害(Mild Cognitive Impairment;MCI)では、標準プロフィール点が15点以下、スクリーニング点が5点以下となることが多いです。
アルツハイマー病では、標準プロフィール点が5点以下、スクリーニング点が1点以下まで低下してきます。
私の検討した結果では、HDS-Rが26点辺りまで低下してきますと、RBMTが基準点以下に低下していることが多く、「初期アルツハイマー病」と診断される可能性が出てきます。
認知症が専門ではない医師の場合には、HDS-Rが26点も獲得できればそれだけで「異常なし」と判断してしまい、精密検査を実施しないことも多いですので診断医の力量には留意する必要があります。
Facebookコメント
MMSE(http://ja.wikipedia.org/wiki/%E3%83%9F%E3%83%8B%E3%83%A1%E3%83%B3%E3%82%BF%E3%83%AB%E3%82%B9%E3%83%86%E3%83%BC%E3%83%88%E6%A4%9C%E6%9F%BB)における3単語(「桜」・「猫」・「電車」)の想起について:
「直後再生は主に注意課題、遅延再生は記憶課題である。」(吉益晴夫:神経心理学的検査. 日本医師会雑誌・生涯教育シリーズ85 神経・精神疾患診療マニュアル Vol.142・特別号(2) S58-59 2013)
ADD(注意欠陥障害) [発達障害]
子供の発達障害 一人で悩まずに
保護者同士、情報を交換 ■専門家に相談
適切な教育支援 早く
新年度が始まって約3カ月。小学校では保育園の段階では気付かなかった子供の発達障害が分かることも少なくない。もし、我が子に発達障害の疑いが生じたら、どうすればいいのか。保護者の体験談や専門家のアドバイスから基本的な対応を探った。
ほぼ毎月茶話会
5月のある日。東京都調布市で発達博害やその疑いがある子供の保護者の茶話会が開かれた。同市の一般社団法人「発達心理ライフケア協会」がほぼ毎月開催しており、事前の申し込みは不要だ。代表の春日佳奈さん(45)は「特に低年齢の発達障害児の保護者は時間の工面が大変なので、参加しやすくしています」とにこやかに話す。
出席者は11人。初参加の母親(49)は高校1年の次男にADD(注意欠陥障害)があるという。ADDは注意欠陥多動性障害(ADHD)のうち多動(じっとしていられないこと)がないタイプ。このため、次男が小学5年で不登校になるまで、障害に気付かなかった。
…(中略)…
現れ方千差万別
発達障害の現れ方は一人ひとり異なる。育てにくさを感じて親が気づくことも、集団内での様子から教員が気づくこともある。子育てに直面する母親は障害に詳しくなるが、父親や祖父母の理解が足りないことで母親の精神的負担が増すことも少なくない。それゆえ「母親が苦労や悩みを共有し、情報交換できる茶話会のような湯が必要」(春日さん)なのだという。
発達障害がある子供の保護者を支援する団体は増えている。インターネットのほか、教育支援センターなど自治体の窓口で情報が得られることもあるので相談してみてもよいだろう。 (ライター仲尾匡代)
発達障がいファミリーサポートMarble・国沢真弓代表理事に聞く

――就学時健診では発達障害かどうかはわからないのですか。
「発達障害があってもおとなしく知能テストを受けられる子は、知能に問題がない限り分からないでしょう。コミュニケーションが極端に難しければ面談の際に分かりますが、そうした子は幼稚園や保育園で判明していることが多いはずです」
――一口に発達障害と言っても、障害の現れ方は一人ずつ違いますね。
「障害への対応は、医師や専門家、先輩保護者などの助言の中から我が子に合うものを選ぶ必要があります。すぐにベストを見つけるのは難しく、べターを選ぶぐらいの構えがよいでしょう」
「発達障害のある子は困った子ではなく、困っている子です。周囲に理解がないと、叱られたり非難されたりして、自己肯定感が低くなりがちです。その状態がひどくなると、不登校や引きこもりにもなりかねません」
「それを避けるためにも、家庭と学校が連携をとりながら、適切な教育支援を受けることが大切。子供の障害と向き合い、支援を上手に活用すれば、社会で生きる力を育むことともできるのです」
▼発達障害
自閉症スペクトラム障害(ASD)、学習障害(LD)、注意欠陥多動性障害(ADHD)や、これらに類する脳機能の障害。ASDは自閉症、アスペルガー症候群、その他の広汎性発達障害の3つに分類されていたが、最近では1つの連続した障害とみなされる。1人で複数の障害を併せ持つこともある。
【2016年6月24日付日本経済新聞・くらし】
私の感想
4月にご紹介した動画は印象的でしたね。
https://www.facebook.com/atsushi.kasama.9/videos/vb.100004790640447/578924222277261/?type=2&theater
ADD(注意欠陥障害)ってのは初耳だ。専門外の知識は新聞から得るに限る。基礎を新聞で学習したら、その次はネットで情報入手でしょうね。
大人の女性の注意欠陥障害(ADD)
http://adhdadd.seesaa.net/
■ 5.洗濯ができない
■ 6.整理整頓が出来ない
■ 7.紛失対策(学生編)
■ 8.紛失対策(社会人編)
■ 9.時間感覚を養う
■ 10.スケジュール感覚を養う
■ 11.気分が変わりやすい
■ 12.気分の波
■ 13.料理ができない
ADD(注意欠陥障害)の人は事務職は向きません
http://edu.markelog.net/%E7%99%BA%E9%81%94%E9%9A%9C%E5%AE%B3/%E6%B3%A8%E6%84%8F%E6%AC%A0%E9%99%A5%E5%A4%9A%E5%8B%95%E6%80%A7%E9%9A%9C%E5%AE%B3adhd/add-jimujo/
何度注意されても同じミスをします。
事務系の職種で苦労している人は、ADDぽい人が多数いるようです。
私が見てきた人でもそんな様子でした。
•机の上がポストイットまみれになっている
•何事も細かすぎるチェックリストが必要になる
•それでも何度もミスをする
•作業をしていると他の事が気になる
•他の事をすると最初にしていた作業でもミスをする
保護者同士、情報を交換 ■専門家に相談
適切な教育支援 早く
新年度が始まって約3カ月。小学校では保育園の段階では気付かなかった子供の発達障害が分かることも少なくない。もし、我が子に発達障害の疑いが生じたら、どうすればいいのか。保護者の体験談や専門家のアドバイスから基本的な対応を探った。
ほぼ毎月茶話会
5月のある日。東京都調布市で発達博害やその疑いがある子供の保護者の茶話会が開かれた。同市の一般社団法人「発達心理ライフケア協会」がほぼ毎月開催しており、事前の申し込みは不要だ。代表の春日佳奈さん(45)は「特に低年齢の発達障害児の保護者は時間の工面が大変なので、参加しやすくしています」とにこやかに話す。
出席者は11人。初参加の母親(49)は高校1年の次男にADD(注意欠陥障害)があるという。ADDは注意欠陥多動性障害(ADHD)のうち多動(じっとしていられないこと)がないタイプ。このため、次男が小学5年で不登校になるまで、障害に気付かなかった。
…(中略)…
現れ方千差万別
発達障害の現れ方は一人ひとり異なる。育てにくさを感じて親が気づくことも、集団内での様子から教員が気づくこともある。子育てに直面する母親は障害に詳しくなるが、父親や祖父母の理解が足りないことで母親の精神的負担が増すことも少なくない。それゆえ「母親が苦労や悩みを共有し、情報交換できる茶話会のような湯が必要」(春日さん)なのだという。
発達障害がある子供の保護者を支援する団体は増えている。インターネットのほか、教育支援センターなど自治体の窓口で情報が得られることもあるので相談してみてもよいだろう。 (ライター仲尾匡代)
発達障がいファミリーサポートMarble・国沢真弓代表理事に聞く

――就学時健診では発達障害かどうかはわからないのですか。
「発達障害があってもおとなしく知能テストを受けられる子は、知能に問題がない限り分からないでしょう。コミュニケーションが極端に難しければ面談の際に分かりますが、そうした子は幼稚園や保育園で判明していることが多いはずです」
――一口に発達障害と言っても、障害の現れ方は一人ずつ違いますね。
「障害への対応は、医師や専門家、先輩保護者などの助言の中から我が子に合うものを選ぶ必要があります。すぐにベストを見つけるのは難しく、べターを選ぶぐらいの構えがよいでしょう」
「発達障害のある子は困った子ではなく、困っている子です。周囲に理解がないと、叱られたり非難されたりして、自己肯定感が低くなりがちです。その状態がひどくなると、不登校や引きこもりにもなりかねません」
「それを避けるためにも、家庭と学校が連携をとりながら、適切な教育支援を受けることが大切。子供の障害と向き合い、支援を上手に活用すれば、社会で生きる力を育むことともできるのです」
▼発達障害
自閉症スペクトラム障害(ASD)、学習障害(LD)、注意欠陥多動性障害(ADHD)や、これらに類する脳機能の障害。ASDは自閉症、アスペルガー症候群、その他の広汎性発達障害の3つに分類されていたが、最近では1つの連続した障害とみなされる。1人で複数の障害を併せ持つこともある。
【2016年6月24日付日本経済新聞・くらし】
私の感想
4月にご紹介した動画は印象的でしたね。
https://www.facebook.com/atsushi.kasama.9/videos/vb.100004790640447/578924222277261/?type=2&theater
ADD(注意欠陥障害)ってのは初耳だ。専門外の知識は新聞から得るに限る。基礎を新聞で学習したら、その次はネットで情報入手でしょうね。
大人の女性の注意欠陥障害(ADD)
http://adhdadd.seesaa.net/
■ 5.洗濯ができない
■ 6.整理整頓が出来ない
■ 7.紛失対策(学生編)
■ 8.紛失対策(社会人編)
■ 9.時間感覚を養う
■ 10.スケジュール感覚を養う
■ 11.気分が変わりやすい
■ 12.気分の波
■ 13.料理ができない
ADD(注意欠陥障害)の人は事務職は向きません
http://edu.markelog.net/%E7%99%BA%E9%81%94%E9%9A%9C%E5%AE%B3/%E6%B3%A8%E6%84%8F%E6%AC%A0%E9%99%A5%E5%A4%9A%E5%8B%95%E6%80%A7%E9%9A%9C%E5%AE%B3adhd/add-jimujo/
何度注意されても同じミスをします。
事務系の職種で苦労している人は、ADDぽい人が多数いるようです。
私が見てきた人でもそんな様子でした。
•机の上がポストイットまみれになっている
•何事も細かすぎるチェックリストが必要になる
•それでも何度もミスをする
•作業をしていると他の事が気になる
•他の事をすると最初にしていた作業でもミスをする



